硅是重要的半导体材料,构成了现代电子工业的基础。请回答下列问题:
(1)基态原子中,电子占据的最高能层符号为,该能层具有的原子轨道数为、电子数为。
(2)硅主要以硅酸盐、等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以相结合,其晶胞中共有8个原子,其中在面心位置贡献个原子。
(4)单质硅可通过甲硅烷()分解反应来制备。工业上采用和在液氨介质中反应制得,该反应的化学方程式为。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 |
||||||
| 键能/( | 356 |
413 |
336 |
226 |
318 |
452 |
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是。
②的稳定性小于,更易生成氧化物,原因是
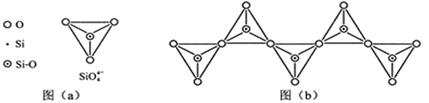
(6)在硅酸盐中 4四面体(如下图())通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图()为一种无限长单链结构的多硅酸根,其中原子的杂化形式为与的原子数之比为化学式为。
某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:(H-1 O-16 Fe-56)
请根据上面流程,回答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须有_______、_____(填仪器名称)
(2)请写出加入溴水发生的离子反应方程式____________________________。
(3)检验沉淀是否已经洗涤干净的操作是_____________________________。
(4)该实验中可以回收利用的物质是________________________________。
(5)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是___(列出原始计算式,不需化简);若称量准确,最终测量的结果偏大,则造成误差的原因可能是_____(写出一种原因即可)。
(6)为进一步探究样品的性质,他们又利用溶液A做了如下一些实验,其中现象、结论均正确的_
______________(填写序号)。
A.向氢氧化镁悬浊液中滴加A溶液出现红褐色沉淀,证明 |
| B.向A溶液中加入少量铁粉,铁粉溶解,溶液颜色由黄色变成浅绿色 |
| C.向沸水中滴加A的饱和溶液,立即出现红褐色沉淀 |
| D.将A溶液加热蒸干并灼烧,得到Fe2O3固体 |
(16分)在一定条件下,NO与NO2混合可生成N2O3 ,反应的化学方程式为:
NO(g)+NO2(g) N2O3(l)△H<0
N2O3(l)△H<0
下图表示一定量的NO、NO2混合气体发生反应时,N02浓度在前25s内的变化。该反应进行到45s时达到平衡,测得NO2浓度约为0.010mol/L。
(1)前20s内,NO2的平均反应速率为_________________。
(2)其他条件不变,①升高温度,NO2的转化率_______ (填“增大”、“减小”或“不变”)。
②压缩气体体积,该反应平衡向_______移动(填“正向”或“逆向”)。
(3)若反应延续至70秒,请在答题卡图中画出25秒至70秒的反应进程曲线。
(4)若在反应开始时加入催化剂(其他条件都不变),请在答题卡图中画出加催化剂后的反应进程曲线。
(5)NO、NO2的混合气体用NaOH溶液吸收,得到的盐只有一种,则该反应的离子方程式为:______,该反应的氧化剂是______________。
香豆素是用途广泛的香料,合成香豆素的路线如下(其他试剂、产物及反应条件均省略):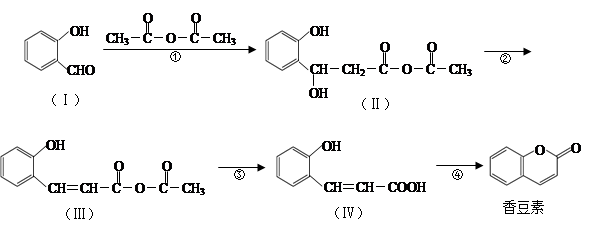
(1)香豆素的分子式为_______;Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为______。
(2)反应②的反应类型是_____________,反应④的反应类型是_____________。
(3)香豆素在过量NaOH溶液中完全水解的化学方程式为_______________。
(4)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,能发生银镜反应。Ⅴ的结构简式为_______________(任写一种)。
(5)一定条件下,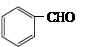 与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物
与CH3CHO能发生类似反应①、②的两步反应,最终生成的有机物
的结构简式为_____________。
(16分)铜及其化合物在生产和生活实际中应用广泛。
Ⅰ.某学习小组对粗铜提纯(电解精炼)后的阳极泥(主要成分为银、金)进行如下实验。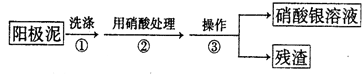
(1)操作③所需的仪器有:烧杯、。
(2)稀硝酸处理阳极泥得到硝酸银稀溶液,写出该步反应的化学方程式______。
(3)为了回收金,他们查阅了有关资料如下表:
| 编号 |
常温下反应 |
化学平衡常数 |
| 反应1 |
Au + 6HNO3  Au(NO3)3 + 3NO2↑+ 3H2O Au(NO3)3 + 3NO2↑+ 3H2O |
<10−5 |
| 反应2 |
Au3+ + Cl− [AuCl4]− [AuCl4]− |
>105 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为1∶3的混合物)。请你运用化学平衡移动原理,简要说明金能溶于王水的原因:。
Ⅱ.实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:
请回答有关问题: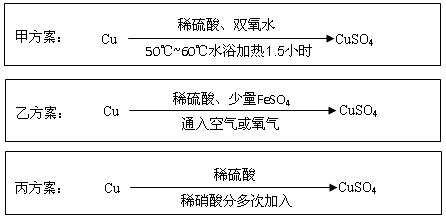
(4)甲方案:将6.4g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50℃。加入40 mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0 g【已知有关摩尔质量:M(Cu)="64" g/mol, M(CuSO4·5H2O) ="250" g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是;
②本实验CuSO4·5H2O的产率为。
(5)乙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的(填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是;
(6)丙方案:为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)=。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: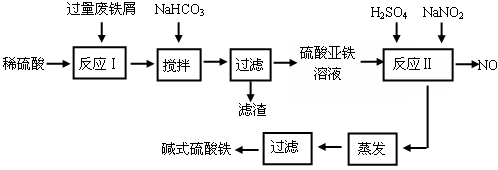
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在范围内,使溶液中的沉淀(写离子符号)。
(2)反应Ⅱ中加入NaNO2的目的是,发生反应的离子方程式为。
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液