电解装置如图所示,电解槽内装有及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。
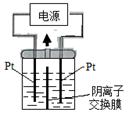
已知:
下列说法不正确的是
| A. | 右侧发生的电极方程式: ↑ |
| B. | 电解结束时,右侧溶液中含有 |
| C. | 电解槽内发生反应的总化学方程式 ↑ |
| D. | 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变 |
强弱电解质的本质区别是 ()
| A.导电能力 | B.相对分子质量 |
| C.电离程度 | D.溶解度 |
、对于任何一个平衡体系,采用以下措施一定会使平衡移动的是()
| A.加入一种反应物 |
| B.升高温度 |
| C.对平衡体系增加压强 |
| D.使用催化剂 |
某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为()
A、铝B、铜C、锡D硅
据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是 ()
| A.Fe -2e-=Fe2+ | B.2H2O+O2+4e-=4OH- |
| C.2H++2e-=H2↑ | D.4OH-- 4e-=2H2O+O2↑ |
随着人们生活质量的不断提高,废电池必须集中处理的问题被提到议事日程,首要原因是()
| A.利用电池外壳的金属材料 |
| B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 |
| C.不使电池中渗泄的电解液腐蚀其他物品 |
| D.回收其中石墨电极 |