水果成熟时,大多数香气袭人。乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成。有关物质的物理性质见右表。合成过程如下:第一步:将丁醇和x的混合液和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯。
| |
乙酸 |
1-丁醇 |
乙酸丁酯 |
| 熔点/℃ |
16.6 |
-89.5 |
-73.5 |
| 沸点/℃ |
117.9 |
117 |
126.3 |
| 密度/g·cm-3 |
1.05 |
0.81 |
0.88 |
| 水溶性 |
互溶 |
互溶 |
不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)C→F→ → → → 。
(2)C装置中除了装有1-丁醇和过量的乙酸外,还装有___________、_________。装置C中冷凝管的作用是: ;
(3)乙酸过量的原因是________________。
(4)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是_____ ___ _
(5)步骤E的操作要领是:①用一只手的手掌压住分液漏斗的塞子并握住分液漏斗;②另一只手握住活塞部分;③ 。
(6)要除去乙酸丁酯中含有的少量乙酸,下列试剂中可选用的是:
A. 饱和NaOH溶液 B. 饱和KHCO3溶液
C.饱和Na2CO3溶液 D. 饱和 K2CO3溶液
E. 饱和KOH溶液 F.过量的 1-丁醇
某课外活动小组对一氧化碳还原氧化铁的实验中最后的产物产生浓厚的兴趣,试通过实验来探究其成分。
Ⅰ.实验装置: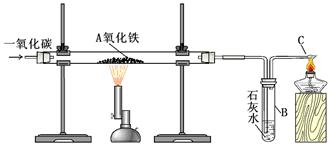
用一氧化碳还原氧化铁的实验装置
该装置B中发生的离子方程式是
装置B的作用是
Ⅱ.实验现象:玻璃管A中的粉末由红色逐渐变为黑色时,停止加热,继续通一氧化碳,冷却到室温,停止通气,同时观察到澄清的石灰水变浑浊。
Ⅲ.实验结论:
甲认为:依据上述实验现象可以判断出生成的黑色固体为金属铁。
乙认为:仅从上述实验现象,不足以证明生成的黑色固体为金属铁,她增加了一个实验:用磁铁靠近生成的黑色固体,看到有黑色固体被磁铁吸引。于是得出生成的黑色固体为金属铁的结论。
请你通过该反应的相关资料对他们结论作出判断并通过实验检验其合理性:
(1)在一定条件下:一氧化碳与氧化铁在加热条件下,可发生如下反应
3Fe2O3+CO 2Fe3O4+CO2
2Fe3O4+CO2
Fe3O4+4CO 4Fe+4CO2
4Fe+4CO2
(2)四氧化三铁(Fe3O4)为黑色固体,有强磁性,能够被磁铁吸引。
甲、乙同学的结论:你对此评价的理由是:
Ⅳ.实验探究
对反应后固体成分提出假设:
假设1:反应后固体中只有Fe;
假设2:反应后固体中只有Fe3O4;
假设3:反应后固体中_______________________
为确定实验中最后的产物的成分,丙同学设计如下实验,请您利用限选试剂和仪器帮助他完成该探究过程,并将答案写在答题卡相应位置。
限选试剂和仪器: 1mol/LCuSO4 、0.01mol/L KSCN溶液、1mol/L盐酸、0.01mol/L氯水、试管、玻璃棒、胶头滴管。
| 实验操作 |
预期现象和结论 |
| 步骤一:取硬质玻璃管中固体产物少量分别于A、B试管中,加入足量1mol/LCuSO4溶液、搅拌溶解。 |
(1)若A试管中黑色固体不溶解,并且没有观察到其他现象,则黑色固体为 (2)若B试管中有红色固体析出,则说明黑色固体中含有Fe。 |
| 步骤二:对试管B中溶液过滤,将所得固体洗涤干净后,加足量1mol/L盐酸后,再依次分别加入适量0.01mol/L氯水、少量0.01mol/L KSCN溶液 |
(1)若溶液不变红色,则 (2)若溶液变红色,则 |
Ⅴ.延伸探究:丁同学试图通过反应前后固体质量的变化来确定黑色固体的成分,你认为可行吗?(假设氧化铁在反应中完全反应)(填“行”或“不行”)理由是。
资料显示:在一定条件下黄铵铁钒在pH=0.5~2.5范围内均能稳定存在,工业上用酸浸法制取硫酸铜的流程示意图如下: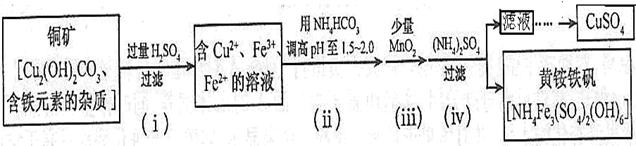
根据题意完成下列问题:
(1)步骤(ii)所加试剂起调节pH作用的离子是 (填离子符号)。
(2)在步骤(iii)发生的反应中,加入少量MnO2的作用是
(3)步骤(iv)除去杂质的离子方程式可表示为
(4)实验室模拟碱式碳酸铜[Cu2(OH)2CO3]的制备,向大试管中加入碳酸钠溶液和硫酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。根据上述碱式碳酸铜的制备方法,请完成以下问题:
①过滤后洗涤的目的是什么;简述如何洗涤沉淀
②若实验得到a g样品(只含CuO杂质),取此样品加热至分解完全后,得到b g固体,此样品中碱式碳酸铜的质量分数是
重铬酸钠(Na2Cr2O7·2H2O)俗称红矾钠,是一种重要的无机盐产品,可作氧化剂,在印染、颜料、电镀、医药等工业方面有广泛的用途。某化学兴趣小组设计实验测定市场上的红矾钠中Na2Cr2O7的质量分数,其步骤如下:
I.称取Wg红矾钠,溶于酸配成l00mL溶液;
Ⅱ.用cmol·L-1的标准KMnO4酸性溶液滴定20.00mL一定浓度的FeSO4溶液,消耗KMnO4溶液20.00rnL;
Ⅲ。取20.00mL Na2Cr2O7溶液,用上述FeSO4溶液滴定,达到滴定终点时,消耗24.00mLFeSO4溶液;
查阅资料知:Cr2O72-在酸性条件下具有强氧化性,易被还原为Cr3+
回答下列问题:
(1)Na2Cr2O7与FeSO4的反应离子方程式为.
(2)步骤Ⅱ中的滴定过程,滴定终点的现象为;选用(填“酸式”或“碱式”)滴定管。
(3)已知:MnO4-+5Fe2++8H+==Mn2++5Fe3++4H2O,此红矾钠中Na2Cr2O7的质量分数的表达式为。
(4)判断下列操作对Na2Cr2O7的质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”):
①步骤Ⅲ中的滴定过程,滴定终点读数时俯视读数;
②配制c mol·L-1的KMnO4标准溶液时,转移时有少量溶液洒出。
(5)[实验探究]有同学提出FeSO4有很强的还原性,在空气中易被氧化而变质,因此对测定结果会造成影响,请你分析后指出,如果FeSO4变质,对测定结果的影响是(填“偏高”、“偏低”或“无影响”)。
请设计一个简单实验检验FeSO4溶液是否变质。
乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平。结合以下路线回答: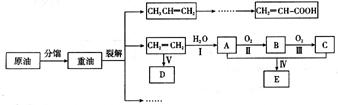
已知: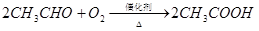
(1)反应II的化学方程式是。
(2)D为高分子化合物,可以用来制造多种包装材料,其结构简式是。
(3)E是有香味的物质,在实验室用下图装置制取。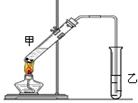
①反应IV的化学方程式是,该反应类型为。
②该装置图中有一个明显的错误是。
(4)为了证明浓硫酸在反应IV中起到了催化剂和吸水剂的作用,某同学利用上图改进后装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管乙再测有机层的厚度,实验记录如下:
| 实验编号 |
试管甲中试剂 |
试管乙中试剂 |
有机层的厚度/cm |
| A |
2 mL乙醇、1 mL乙酸、 1mL18mol·L-1浓硫酸 |
饱和Na2CO3溶液 |
3.0 |
| B |
2 mL乙醇、1 mL乙酸 |
0.1 |
|
| C |
2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 |
0.6 |
|
| D |
2 mL乙醇、1 mL乙酸、盐酸 |
0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是3mL和mol·L-1。
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快。由此判断,影响化学反应速率的因素有和。
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
| 时间/min |
1 |
2 |
3 |
4 |
5 |
| 体积/mL |
50 |
120 |
232 |
290 |
310 |
①哪一时间段反应速率最大(填“0~1 min”或“1~2 min”或“2~3 min”或“3~4 min”或“4~5min”)。
②2~3 min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为。
③试分析1~3min时间段里,反应速率变大的主要原因。