在一个密闭容器中,盛有N2和H2,它们的起始浓度分别是1.8 mol·L-1和5.4 mol·L-1,在一定的条件下它们反应生成NH3,10min后测得N2的浓度是0.8 mol·L-1,则在这10min内NH3的平均反应速率是
| A.0.1 mol·L-1·min-1 | B.0.3 mol·L-1·min-1 |
| C.0.2 mol·L-1·min-1 | D.0.6 mol·L-1·min-1 |
下列物质存放方法正确的是
| A.少量的钠保存在无水乙醇中 | B.药品柜的同一层不可同时存放浓硝酸和浓氨水 |
| C.少量白磷保存在二硫化碳中 | D.硅酸钠溶液保存在有玻璃塞的试剂瓶中 |
在实验室进行下列实验时,必须在反应物中加入碎瓷片以防止暴沸的有
| A.制银镜 | B.制二溴乙烷 | C.裂化石蜡 | D.蒸馏石油 |
下列物质与常用危险化学品的类别不对应的是
| A.H2SO4、NaOH——腐蚀品 | B.CH4、C2H4——易燃液体 |
| C.CaC2、Na——遇湿易燃物品 | D.KMnO4、K2Cr2O7——氧化剂 |
“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。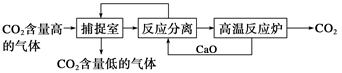
下列有关该方法的叙述中正确的是
| A.能耗小是该方法的一大优点 |
| B.整个过程中,只有一种物质可以循环利用 |
| C.“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤 |
| D.该方法可减少碳排放,捕捉到的CO2还可用来制备甲醇等产品 |
在一定的温度、压强下,向100 mL CH4和Ar的混合气体中通入400 mL O2,点燃使其完全反应,最后在相同条件下得到干燥气体460 mL,则反应前混合气体中CH4和Ar的物质的量之比为
| A.1∶4 | B.1∶3 | C.1∶2 | D.1∶1 |