有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1 NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
| 实验步骤 |
实验结论 |
(1)A的质谱图如下: |
(1)证明A的相对分子质量为:__________。 |
| (2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 |
(2)证明A的分子式为: ________________。 |
| (3)另取两份9.0 g A分置于不同的试管中。 往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 |
(3)证明A的分子中含有一个羧基和一个羟基。 |
(4)A的核磁共振氢谱如下图: |
(4)A的结构简式为: _________________________。 |
原电池是将能转化为能。其中,电子流出的一极是原电池的极,电子流入的一极是原电池的极,原电池的负极发生反应。
(共10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
|||
| 4 |
⑨ |
(1)在这些元素中,化学性质最不活泼的是:(填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____________,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式______。
(4)用电子式表示元素④与⑥的化合物的形成过程:,该化合物属于(填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式,该化合物是由(填“极性”或“非极性”)键形成的。
A、B、C、D 4种元素,A元素所处的周期数、主族序数、原子序数均相等;B的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C.
(1)B元素的名称________;B在周期表中的位置:第________周期,第________族;
(2)A、B形成的化合物的化学式________;
(3)C的元素符号________,C的最高价氧化物的化学式________;
(4)D的最高价氧化物对应的水化物的化学式________________。
(共4分)下列五种物质中 ①Ne ②H2O ③NH3 ④KOH ⑤Na2O(填写序号):只存在共价键的是,只存在离子键的是,既存在共价键又存在离子键的是,不存在化学键的是。
(共4分)(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片(如图甲所示),可观察到铜片上(填“有”或“没有”)气泡产生,再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上(填“有”或“没有”)气泡产生。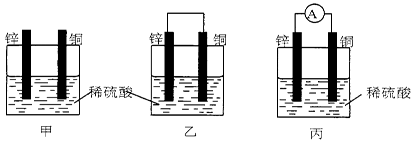
(2)用导线连接灵敏电流表的两端后,再与溶液中的锌片和铜片相连(如图丙所示),观察到灵敏电流表的指针发生了偏转,说明了导线中有电流通过。有关的电极反应式:
锌片________________;铜片________________