科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲
醇。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、
-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 ;
(2)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,考查温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
下列说法正确的是 (填序号)
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol·L-1·min-1
mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时 增大
增大
(3)在T1温度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强之比为 ;
某研究小组以甲苯为主要原料,采用以下路线合成医药中间体F和Y。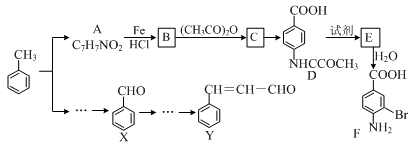
已知:①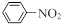
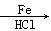
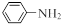
②2CH3CHO 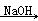 CH3CH(OH)CH2CHO
CH3CH(OH)CH2CHO 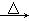 CH3CH=CHCHO
CH3CH=CHCHO
请回答下列问题:
(1)下列有关F的说法正确的是 。
| A.分子式是C7H7NO2Br |
| B.能形成内盐 |
| C.能发生取代反应和缩聚反应 |
| D.1 mol的 F最多可以和2 mol NaOH反应 |
(2)C→ D的反应类型是 。
(3)B→C的化学方程式是 。
在合成F的过程中,B→C步骤不能省略,理由是 。
(4)D→E反应所需的试剂是 。
(5)写出同时符合下列条件的A的同分异构体的结构简式 (写出3个)。
①苯环上只有两种不同化学环境的氢原子
②分子中含有 -CHO
(6)以X和乙烯为原料可合成Y,请设计合成路线(无机试剂及溶剂任选)。
注:合成路线的书写格式参照如下示例流程图:
CH3CHO  CH3COOH
CH3COOH 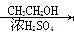 CH3COOCH2CH3
CH3COOCH2CH3
有机物F的合成路线如图所示:
已知以下信息:
(1)RCOOR’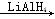 RCH2OH
RCH2OH
(2)
回答以下问题:
(1)A的结构简式为 ,G的结构简式为 。
(2)B生成C的化学方程式为 。
(3)检验E中含氧官能团的试剂是 ,现象是 。
(4)E→F的反应类型是 。
(5)A的同分异构体中,符合下列条件的同分异构体有 种(不包含A),写出其中一种的结构简式 。
①属于芳香族化合物
②苯环上有四个取代基
③苯环上的一溴取代物只有一种
对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。出下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为l :1。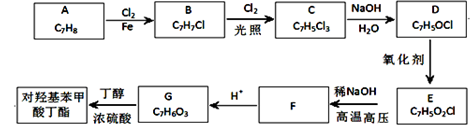
回答下列问题:
(1)A的化学名称为 ;
(2)由B生成C的化学反应方程式为 ;
该反应的类型为 ;
(3)D的结构简式为 ;
(4)F的分子式为 ;
(5)G的结构简式为 ;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有 种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2:2:1,的是 (写结构简式)。
萜品醇可作为消毒剂、抗氧化剂、医药和溶剂。合成a-萜品醇G的路线之一如下: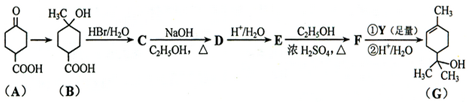
已知:RCOOC2H5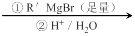
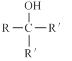
请回答下列问题:
⑴ A所含官能团的名称是________________。
⑵ A催化氢化得Z(C7H12O3),写出Z在一定条件下聚合反应的化学方程式:
_______________________________________________________________。
⑶ B的分子式为_________;写出同时满足下列条件的B的链状同分异构体的结构简式:_____________。
① 核磁共振氢谱有2个吸收峰② 能发生银镜反应
(4) B → C、E → F的反应类型分别为_____________、_____________。
⑸ C → D的化学方程式为____________________________________________。
⑹ 试剂Y的结构简式为______________________。
⑺ 通过常温下的反应,区别E、F和G的试剂是______________和_____________。
⑻ G与H2O催化加成得不含手性碳原子(连有4个不同原子或原子团的碳原子叫手性碳原子)的化合物H,写出H的结构简式:________________________。
PBS是一种可降解的聚酯类高分子材料,可由马来酸酐等原料经下列路线合成: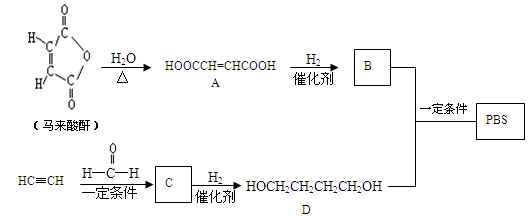
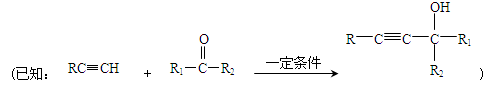
(1)A→B的反应类型是 ;B的结构简式是 。
(2)C中含有的官能团名称是 ;D的名称(系统命名)是 。
(3)半方酸是马来酸酐的同分异构体,分子中含1个环(四元碳环)和1个羟基,但不含—O—O—键。半方酸的结构简式是 。
(4)由D和B合成PBS的化学方程式是 。
(5)下列关于A的说法正确的是 。
a.能使酸性KMnO4溶液或溴的CCl4溶液褪色
b.能与Na2CO3反应,但不与HBr反应
c.能与新制Cu(OH)2反应
d.1molA完全燃烧消耗5molO2