在密闭容器中,反应X2(g)+Y2(g)  2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )
2XY(g);ΔH<0,达到甲平衡。在仅改变某一条件后,达到乙平衡,对此过程的分析正确的是( )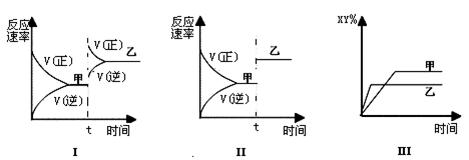
| A.图Ⅰ是加入适当催化剂的变化情况 | B.图Ⅱ是扩大容器体积的变化情况 |
| C.图Ⅲ是增大压强的变化情况 | D.图Ⅲ是升高温度的变化情况 |
已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
| A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H=-4b kJ/mol |
| B.C2H2(g) + 5/2O2(g) = 2CO2(g) + H2O(l) △H="2b" kJ/mol |
| C.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H=-2b kJ/mol |
| D.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H="b" kJ/mol |
将等质量的两份锌粉a、b分别加入过量的稀硫酸,同时向a中加少量CuSO4溶液,下图中产生H2的体积V(L)与时间t(min)的关系,其中正确的是

已知1mol白磷转化成1mol红磷,放出18.39 kJ热量,又知:P4(白,s)+5O2= 2P2O5(s)ΔH1,4P(红,s)+5O2=2P2O5(s)ΔH2则ΔH1和ΔH2的关系正确的是
| A.ΔH1>ΔH2 | B.ΔH1<ΔH2 | C.ΔH1=ΔH2 | D.无法确定 |
已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量
②1molCl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量。
下列叙述正确的是
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)===2HCl(g) |
| B.氢气与氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol |
| C.氢气与氯气反应生成2mol氯化氢气体,反应的△H=—183kJ/mol |
| D.氢气与氯气反应生成1mol氯化氢气体,反应的△H=—183kJ/mol |
如图所示是298 K时,N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
A.该反应的热化学方程式为:N2+3H2 2NH3ΔH=-92 kJ/mol 2NH3ΔH=-92 kJ/mol |
| B.a曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q |