相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始、平衡时的有关数据如下表所示:
| 容器编号 |
起始时各物质的物质的量/mol |
达平衡时体系能量的变化 |
||
| N2 |
H2 |
NH3 |
||
| ① |
1 |
3 |
0 |
放出热量:23.15 kJ |
| ② |
0.9 |
2.7 |
0.2 |
放出热量:Q |
下列叙述错误的是 ( )
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为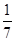
C.容器②中达平衡时放出的热量Q=23.15 kJ
D.若容器 ① 的体积为0.5 L,则平衡时放出的热量小于23.15 Kj
下列对一些实验事实的理论解释不正确的是 ( )
| 选项 |
客观事实 |
理论解释 |
| A. |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力 |
| B. |
酸性:HClO<H2CO3 |
非金属:C>Cl |
| C. |
原子半径:Cl<S |
Cl、S原子电子层数相同,但氯原子核电荷数较硫多,对核外电子吸引能力比硫强 |
| D. |
水分子比H2S分子稳定 |
H-O键比H-S键稳定 |
下列物质固态时,一定是分子晶体的是()
| A.酸性氧化物 | B.非金属单质 | C.碱性氧化物 | D.含氧酸 |
向下列配合物的水溶液中加入AgNO3溶液不能生成AgCl沉淀的是
| A.[Co(NH3)4Cl2]Cl | B.[Co(NH3)3Cl3] | C.[Co(NH3)6]Cl3 | D.[Co(NH3)5Cl]Cl2 |
关于原子轨道的说法正确的是
| A.凡是中心原子采取sp3杂化轨道成键的分子其立体构型都是正四面体形 |
| B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的 |
| C.sp3杂化轨道是由同一个原子中能量相近的s轨道和p轨道混合起来形成的一组能量相近的新轨道 |
| D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键 |
下列各组元素性质的递变情况错误的是
| A.Li、Be、B原子最外层电子数依次增多 | B.P、S、Cl元素最高正价依次升高 |
| C.N、O、F电负性依次增大 | D.Na、Mg、Al第一电离能逐渐增大 |