下列推断正确的是 ( )
| A.BF3是三角锥形分子 |
B. 的电子式: 的电子式: ,离子呈平面形结构 ,离子呈平面形结构 |
| C.CH4分子中的4个C—H键都是氢原子的1s轨道与碳原子的p轨道形成的sp σ键 |
| D.CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—H σ键 |
下列反应既是氧化还原反应,又是吸热反应的是
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与H2O反应 | D.甲烷在O2中的燃烧反应 |
在温度、容积相同的2个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1 mol N2、3 mol H2 |
4 mol NH3 |
| NH3的浓度(mol·L-1) |
c1 |
c2 |
| 反应的能量变化 |
放出a kJ |
吸收b kJ |
| 气体密度 |
ρ1 |
ρ2 |
| 反应物转化率 |
α1 |
α2 |
(已知N2(g)+3H2(g) 2NH3(g);ΔH=-92.4 kJ·mol-1),下列说法正确的是
2NH3(g);ΔH=-92.4 kJ·mol-1),下列说法正确的是
A.c1<c2<2c1B.a+b>92.4 C.α1+α 2=1 D.ρ2=3ρ1
常温下,向10 mL 0.1 mol·L-1的H2C2O4溶液中逐滴加入0.1 mol·L-1 KOH溶液,所得滴定曲线如图所示。下列说法正确的是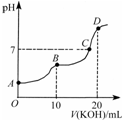
| A.KHC2O4溶液呈弱碱性 |
| B.B点时:c(HC2O4-)>c(K+)>c(H+)>c(OH-) |
| C.C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4) |
| D.D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
下列根据实验操作和现象所得出的结论不正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 |
2 min后,试管里出现凝胶 |
酸性:盐酸>硅酸 |
| B |
在酒精灯上加热铝箔 |
铝箔熔化但不滴落 |
熔点:氧化铝>铝 |
| C |
常温下,向浓硫酸中投入铁片 |
铁片不溶解 |
常温下,铁不与浓硫酸反应 |
| D |
向某溶液中先滴加KSCN溶液,再滴加少量氯水 |
先无明显现象,后溶液变成血红色 |
溶液中含有Fe2+,没有Fe3+ |
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是
| A.Y可用于制造高性能可充电电池 |
| B.WX3的沸点高于ZX3 |
| C.Z的最高价含氧酸的酸性弱于W的最高价含氧酸的酸性 |
| D.原子半径的大小顺序:rW>rZ>rY>rX |