若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A.氢键;分子间作用力;非极性键 | B.氢键;氢键;极性键 |
| C.氢键;极性键;分子间作用力 | D.分子间作用力;氢键;非极性键 |
已知:①H2O(g)=H2O(l) ΔH1=-Q1 kJ·mol-1
②C2H5OH(g)=C2H5OH(l)ΔH2=-Q2 kJ·mol-1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)ΔH3=-Q3 kJ·mol-1
若使23 g液态无水酒精完全燃烧,最后恢复到室温,则放出的热量为(单位:kJ)( )
| A.Q1+Q2+Q3 |
| B.1.5Q1-0.5Q2+0.5Q3 |
| C.0.5Q1-1.5Q2+0.5Q3 |
| D.0.5(Q1+Q2+Q3) |
发射用的运载火箭使用的是以液氢为燃烧剂,液氧为氧化剂的高能低温推进剂。
已知:H2(g)+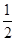 O2(g)=H2O(l)
O2(g)=H2O(l)
ΔH1=-285.8 kJ·mol-1①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1②
O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1④
下列说法正确的是( )
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热ΔH为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+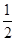 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |
下列说法正确的是( )
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.已知:①2H2(g)+O2(g)=2H2O(g)ΔH=-a kJ·mol-1, ②2H2(g)+O2(g)=2H2O(l)ΔH=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1, |
②C(s,金刚石)+O2(g)=CO2(g)ΔH=-395.0 kJ·mol-1,
则C(s,石墨)=C(s,金刚石) ΔH=+1.5 kJ·mol-1
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是ΔH=-393.5 kJ/mol、ΔH=-285.8 kJ/mol、ΔH=-890.3 kJ/mol、ΔH=-2 800 kJ/mol,则下列热化学方程式正确的是( )
A.C(s)+ O2(g)=CO(g)ΔH=-393.5 kJ/mol O2(g)=CO(g)ΔH=-393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ/mol |
| C.CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-890.3 kJ/mol |
D. C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g)ΔH=-1 400 kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g)ΔH=-1 400 kJ/mol |
已知反应:①101 kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221 kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l)
ΔH=-57.3 kJ/mol下列结论正确的是( )
| A.碳的燃烧热的数值大于110.5 kJ/mol |
| B.①的反应热ΔH为221 kJ/mol |
| C.浓硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol |
| D.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |