酸、碱、盐是有广泛用途的重要化合物。某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动。
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)下图是某试剂瓶标签上的内容。要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为 g。
(3)熟石灰是一种重要的碱,在工农业生产和日常生活中都有十分广泛的应用。工业上首先是用大理石(主要成分碳酸钙)高温煅烧来制取生石灰,然后再用生石灰与水反应来制取熟石灰。请你写出有关反应的化学方程式。
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验。
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质。则无色溶液可能是 。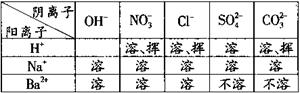
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验。已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰。请根据上表部分物质的溶解性表(20℃)所提供的信息,将下表填写完整。
| 实验目的 |
实验操作 |
现象 |
结论或化学方程式 |
| 除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的氯化钡溶液,充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 |
在滤液中滴加酚酞溶液 |
|
该样品中含有氢氧化钠 |
(5)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数。
某化学兴趣小组对氢氧化钠暴露在空气中是否变质进行了如下探究。
小刚猜想:氢氧化钠可能部分变质。
小强猜想:氢氧化钠可能全部变质。
你的猜想:。
[实验探究]:他们设计探究实验方案,证明了他们各自的猜想。探究过程如下:
| 实验步骤 |
实验操作 |
实验现象 |
实验结论或化学方程式 |
| 步骤一 |
取样品,加水配制成溶液,并向其中滴加过量氯化钙溶液,充分反应后过滤。 |
若没有生成 |
你的猜想正确 |
若有生成 |
氢氧化钠已变质。写出加 入氯化钙溶液后发生反应 的化学方程式 |
||
| 步骤二 |
取上述少量滤液于试管中,滴加无色酚酞溶液。 |
若酚酞溶液变为色 |
氢氧化钠部分变质 |
| 若酚酞溶液色 (填“变”或“不变”) |
氢氧化钠全部变质 |
[表达与交流]:
(1)用化学方程式表示氢氧化钠变质的原因_______________________。
(2)在实验室里氢氧化钠需要保存。药品密封保存的原因很多,请你写出浓盐酸需要密封保存的原因_________________。
下面是甲、乙实验小组完成的相关实验.
甲小组:利用下图装置研究燃烧条件(已知白磷的着火点为40℃).
步骤Ⅰ:烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞。
步骤Ⅱ:用注射器向瓶内推入适量H2O2溶液
(1)H2O2稀溶液与MnO2接触时发生反应的符号表达式为 ,二氧化锰起作用。
(2)实验中,推入H2O2溶液前,燃烧匙和烧杯中水下的白磷均不燃烧,原因分别是、;推入H2O2溶液后,观察到烧杯中的现象是.
乙小组:哪些因素影响着过氧化氢分解的速率?
探究实验1:温度对化学反应速率的影响
探究实验2:浓度对化学反应速率的影响
实验反思:生活中的用品可以代替一些实验仪器,注射器可以代替实验室中的_仪器。
同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
(1)填表
| 实验步骤 |
观察到的现象 |
| ①在试管中取少量盐酸,插入铁丝,充分作用。 |
_ |
| ②在①所得的溶液中,插入,充分作用。 |
无明显现象 |
| ③在②所得的溶液中插入,充分作用。 |
结论:金属活动性Al > Fe > Cu
(2)将铝丝插入前应进行的操作是 ;
(3)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al > Fe > H >Cu的结论。小华要补充的实验是;
(4)小强同学认为要得到Al > Fe > H >Cu的结论,还要做将铝丝插入稀盐酸的实验,你认为(是否)有必要做补充实验,原因是。
某化学兴趣小组利用下图装置探究制取气体的原理、方法及性质。结合装置图,回答下列问题:
(1)写出仪器的名称ab。收集某气体只能用D装置,由此推测该气体具有的性质是、;
(2)用大理石和稀盐酸制取二氧化碳时,可选用的发生与收集装置是(填上图字母),化学方程式是。
(3)该小组设计了如下图所示的实验装置,既可用于制取气体,又可用于探究物质性质。
①当打开K1、关闭K2时,利用I、Ⅱ装置,可进行的实验是(填字母)。
a.大理石与稀盐酸反应制取二氧化碳
b.锌与稀硫酸反应制取氢气
②当打开K2、关闭K1时,可以利用工、Ⅲ装置制得二氧化碳并验证其性质。为了进一步验证产生的气体是二氧化碳,该同学将气体通入Ⅲ中,则该装置中应加入的试剂为(填化学式)。若在f装置中加入紫色石蕊试液,观察到的现象是。得出的结论是。(用化学方程式表达)
竹子是“有节、中空、四季常绿”的植物(如图所示)。
同学们对竹子中的气体成分展开了探究,测定其成分。小资料:
【资料】CO2是一种无色无味的气体,相同条件下密度大于空气的密度,能溶于水,能使澄清的石灰水变浑。
(1)收集竹子中的气体。
小华提出:将一节竹子浸没在水中,在竹子上钻孔,用排水法收集气体。
小刚提出:可用注射器从竹子中抽取气体。
大家认为两人的想法都可行,于是分为A、B两组,在相同的条件下,A组采用小华的取气方法,B组采用小刚的取气方法,分别完成下面的实验。
(2)检验气体中是否含有二氧化碳气体。
| 实验步骤 |
实验现象 |
实验结论及解释 |
| 向所取气体中加入 |
有二氧化碳生成。 |
(3)测定氧气含量。
【查阅资料】红磷的着火点为240℃,白磷的着火点为40℃。
【设计实验】同学们设计了如下图所示的方案一和方案二来测定氧气含量。
【进行实验】按上述两个方案进行多次实验。
【反思与评价】
a.实验中磷的量应为足量,原因是。
b.两个方案的实验测定结果不同,测定结果比较准确的是方案 ,原因是。
c.经过A、B两组同学的实验,A组测得的含氧量总是大于B组的,你认为原因是。