为确定某溶液的离子组成,进行如下实验:①.测定溶液的pH,溶液显强碱性。②.取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体。③.在上述②溶液中再滴加Ba(NO3)2溶液,产生白色沉淀。④.取③ 中上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验以下推测正确的是
| A.一定有SO32-离子 | B.不一定有CO32-离子 |
| C.不能确定Cl-离子是否存在 | D.不能确定HCO3-离子是否存在 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.3mol NO2与足量的水完全反应,被氧化的NO2分子数为2NA |
| B.1 mol异丁烷中含有的共价键数为14NA |
| C.100 mL 18.4 mol/L的浓硫酸与足量的铜充分反应,生成SO2的分子数目为0.92 NA |
| D.甲烷碱性燃料电池中,负极消耗22.4 L甲烷同时消耗10 NA的OH- |
下列实验不能达到目的的是
| 选项 |
实验操作 |
实验目的 |
| A |
向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/L NaCl溶液,产生白色沉淀;再向其中滴加3滴0.1 mol/L的KI溶液,有黄色沉淀产生 |
验证Ksp(AgCl)> Ksp(AgI) |
| B |
向适量样品溶液中滴加KSCN溶液 |
检验FeSO4溶液是否被氧化 |
| C |
向适量样品溶液中滴加盐酸酸化,再滴加BaCl2溶液 |
检验Na2SO3溶液是否被氧化 |
| D |
向Na2SiO3溶液中通入CO2 |
验证非金属性:碳>硅 |
有一个未完成的离子方程式:+XO3-+6H+=3X2+3H2O。据此判断下列说法中正确的是
| A.X可能是周期表中第二周期元素 |
| B.X元素的原子最外层上有7个电子 |
| C.X2是还原产物,H2O是氧化产物 |
| D.若生成3 mol X2,转移6 mol电子 |
下列化学用语表示正确的是
| A.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)= 2H2O(1)△H= -571.6 kJ/mol |
B.肥皂(主要成分为RCOONa)的水溶液显碱性:RCOO一+H2O RCOOH+OH- RCOOH+OH- |
C.实验室制氯气的离子方程式:MnO2+4H++4Cl-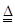 MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
D.乙酸与乙醇反应的化学方程式:CH3CO18OH+C2H5OH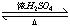 CH3CO18OC2H5+H2O CH3CO18OC2H5+H2O |
下列说法不正确的是
| A.矿物油的主要成分是烃类物质,植物油的主要成分是酯类物质 |
| B.医学中用斐林试剂检验尿液中是否含葡萄糖时利用了葡萄糖的还原性 |
| C.CH3-CH2-CH2-CH3分子中的四个碳原子一定不在同一直线上 |
| D.分子组成为C8Hl0的芳香族化合物有3种 |