某学生为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
① 哪一时间段(指0~1、1~2、2~3、3~4、4~5 min)反应速率最大 ,原因是 。
② 哪一段时段的反应速率最小 ,原因是 。
③ 如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液:A 蒸馏水、B NaCl溶液、C NaNO3溶液、D CuSO4溶液、E Na2CO3溶液,你认为可行的是 。
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:
| 族 周期 |
IA |
0 |
||||||
| 1 |
① |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
(1)画出表中形成化合物种类最多元素的原子结构示意图 __ ;
写出它与原子半径最小的原子形成六核且为平面结构的化合物的电子式_____。
(2)④⑤⑧形成的简单离子半径由大到小的顺序为_______________(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_____________________。(填化学式)
(3)工业上用②单质大量生产⑦单质,反应的化学方程式为:________________________________
⑦形成氧化物的晶体类型为__________,它的一种重要用途为。
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是___________(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式_________________________________。
(5)X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为,写出X溶液与小苏打反应的化学方程式为____________。
烯丙醇是一种无色有刺激性气味的液体,是重要的有机合成原料,其结构简式为 CH2=CH—CH2OH。请回答:
(1)烯丙醇的分子式为;烯丙醇中含有的官能团的名称是____。
(2)0.3mol 烯丙醇与足量金属钠反应,能生成标准状况下的氢气L。
(3)写出烯丙醇与溴水反应的化学方程式,反应类型为:_____________________。
(4)烯丙醇与CH3CO18OH发生酯化反应的化方程式为,酯化反应生成的产物在一定条件下可以发生加聚反应得到高分子化合物,其结构简式为 。
请完成下列两小题
(1)下面列出了几组物质,请选择合适物质的序号填在空格上。
同位素;同系物;同分异构体。
① 金刚石和石墨 ②CH3CH2CH2CH3和(CH3)2CHCH3
③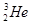 和
和 ④CH3CH3和CH3CH2CH2CH3
④CH3CH3和CH3CH2CH2CH3 ⑤⑥CH2=CHCH3和CH2=CH2;
⑤⑥CH2=CHCH3和CH2=CH2;
⑦D与T ⑧甲酸乙酯和乙酸甲酯
(2)中国的酒文化渊源流长,古代人们便懂得利用粮食、果实等酿制美酒,请写出①葡萄糖转化为乙醇的化学方程式:___________________。
②乙醇催化氧化的化学方程式:______________________________。
某课外活动小组同学用如图装置进行实验,试回答下列问题。
(1)若开始时开关K与a连接,则B极的电极反应式为。
(2)若开始时开关K与b连接,则其总反应的离子方程式为。
(3)若用此装置进行电解K2SO4溶液的实验,试回答以下问题:
①开关K应与连接,
②若标准状况下A极产生2.24 L气体,则溶液中转移_mol电子
③反应一段时间后,溶液的pH(填变大、变小或不变),若要电解质溶液复原,
需向溶液中加入的物质为(填化学式)。
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是。
a.稳定性:甲>乙,沸点:甲>乙
b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙
d.稳定性:甲<乙,沸点:甲>乙
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序(用元素符号作答)
(4)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为。
(5)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于。