下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
⑨ |
|
(1)画出表中形成化合物种类最多元素的原子结构示意图 __ ;
写出它与原子半径最小的原子形成六核且为平面结构的化合物的电子式_____。
(2)④⑤⑧形成的简单离子半径由大到小的顺序为_______________(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为_____________________。(填化学式)
(3)工业上用②单质大量生产⑦单质,反应的化学方程式为:________________________________
⑦形成氧化物的晶体类型为__________,它的一种重要用途为 。
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是___________(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式_________________________________。
(5)X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为 ,写出X溶液与小苏打反应的化学方程式为____________。
下图烧杯中盛有稀硫酸,则:
(1)A中进行的离子反应方程式为。
(2)B中各电极的电极反应式:负极:;正极: 。
(3)C中被腐蚀的金属是,正极反应。
(4)三烧杯中铁被腐蚀的速率由快到慢的顺序是。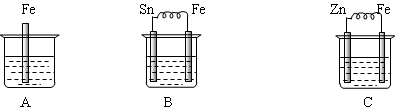
(教材变式题)对于反应:2SO2+O2 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
| 编号 |
改变的条件 |
化学反应速率 |
| ① |
降低温度 |
|
| ② |
增大O2的浓度 |
|
| ③ |
使用V2O5作催化剂 |
|
| ④ |
压缩体积 |

现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。
⑴当加入50mLBa(OH)2溶液时,发生反应的离子方程式为,所得溶液中的溶质是,其物质的量浓度为mol·L—1;
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为mL,所得溶液中溶质,则该溶质物质的量浓度为 mol·L-1。
在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。①此混合物中CO和CO2的物质的量比是,②CO的体积分数是,③CO的质量分数是,④C和O的原子个数比是,⑤混合气体的平均摩尔质量是。
下表是某地市场上销售的一种“加碘盐”包装上的部分文字说明。请根据此表,结合中学学过的化学知识,回答下列问题:
| 配料表 |
精制海盐、碘酸钾(KIO3) |
| 含碘量 |
20―40mg/kg |
| 储藏方法 |
密封避光、防潮 |
| 食用方法 |
烹调时待食品熟后加入碘盐 |
(1)根据物质分类中的树状分类法有关知识,在①HIO3 ②碘酸钠 ③KOH ④I2O5 ⑤NaCl五种(填“混合物”或“化合物”或“盐”或“氧化物”)中与碘酸钾(KIO3)属于同类物质的有(填序号)。
(2)推测出碘酸钾(KIO3)的物理性质:碘酸钾(KIO3)溶于水(填“能”或“不能”),化学性质:碘酸钾(KIO3)在受热时(填“分解”或“不分解”)。
(3)写出KIO3的电离方程式 。