某元素的一种同位素X的原子质量数为A,含N个中子,它与1 H原子组成HmX分子,在ag HmX中所含质子的物质的量是( )
A.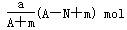 |
B. |
C. |
D. |
在一定条件下,将等体积的NO和 NO2充入试管,并将试管倒立于水槽中,充分反应后剩余气体的体积缩小为原体积的
| A.1/2 | B.1/3 | C.3/8 | D.2/3 |
下列各组物质的稀溶液相互反应,把前者逐滴滴入后者与把后者逐滴滴入前者,所产生的现象相同的是
| A.AlCl3和NaOH | B.Na2CO3和HCl |
| C.NaAlO2和HCl | D.NaCl和AgNO3 |
为了除去FeSO4溶液中少量的Fe2(SO4)3和CuSO4杂质,可选用的试剂是
| A.Fe | B.氨水 | C.NaOH | D.氯水 |
下列可用于检验实验室久置的FeSO4溶液是否含有Fe3+的试剂是
| A.石蕊试液 | B.酚酞试液 | C.新制氯水 | D.KSCN溶液 |
在无色强酸性溶液中,下列各组离子能够大量共存的是
| A.Cl -、Na+、NO3-、Ca2+ | B.NH4+、HCO3-、Cl-、K+ |
| C.K+、Ba2+、Cl-、SO42- | D.Cu2+、NH4+、I-、Cl- |