将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示。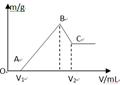
(1)写出BC过程的离子反应方程式
(2)当V1=140mL时,混合物中n(Mg)=_____mol,V2=_____mL
(3)滴入的NaOH溶液_____mL时,溶液中的Mg2+和Al3+刚好沉淀完全。
(4)若混合物中Mg的物质的量分数为a,当滴入的NaOH溶液为450mL时,所得沉淀中无Al(OH)3,则a的取值范围是____________________
(5)当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,能观察到的现象为 ,写出该过程反应的离子方程式 。
实验室进行实验①制乙烯 ②制溴苯 ③石油分馏 ④银镜反应 ⑤制乙酸乙酯
(1)不需要加热的有;
(2)需要水浴的有;
(3)需要加碎瓷片的有;
(4)反应中必须加入浓 的有。
的有。
某烯烃,经与氢气加成反应可得到结构简式为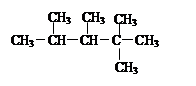 的烷烃,则此烯烃可能的结构简式是:、、。
的烷烃,则此烯烃可能的结构简式是:、、。
硫酸、盐酸和硝酸并称为工业上的“三大酸”,实验室中也常用三大酸制取某些气体,制取、收集及尾气处理装置如图所示(省略加热装置、夹持和净化装置)。仅用此装置和表中提供的部分物质完成相关实验。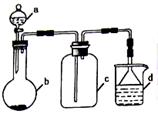
| 序号 |
a中的物质 |
b中的物质 |
c中收集的气体 |
d中的物质 |
| 甲 |
浓硫酸 |
Na2SO3 |
① |
② |
| 乙 |
浓硝酸 |
Cu |
③ |
NaOH |
| 丙 |
浓盐酸 |
MnO2 |
Cl2 |
NaOH溶液 |
按要求回答下列问题:
(1)表格中①②③三种物质分别是__________、__________、________(填化学式)。
(2)实验乙中生成气体③的离子反应方程式为________________________;某同学认为将浓硝酸改为稀硝酸,即可以利用本套装置制取NO气体,该同学的设计________(填“正确”或“不正确”)。
(3)已知实验丙中生成氯气的化学方程式为4HCl(浓)+MnO2  MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
MnCl2+ Cl2↑+2H2O,在该反应中每生成22.4L(标准状况下)氯气,被氧化HCl的物质的量为__________,转移电子的物质的量为________;d装置中发生反应的离子方程式为_________________。实验室还可以用高锰酸钾和浓盐酸反应制取氯气,完成并配平该反应的离子方程式:
____ MnO4-+ ____ H+ + ____ Cl- ____ Mn2+ + ____ Cl2↑+ ____ _________
____ Mn2+ + ____ Cl2↑+ ____ _________
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)已知滤液B的主要成份是硝酸铵,则酸X为_______(填名称,下同),A物质为_______。
(2) 检验操作II后溶液中是否还含铁离子的试剂是(填化学式),如果有则观察到的现象是____________。
检验操作II后溶液中是否还含铁离子的试剂是(填化学式),如果有则观察到的现象是____________。
(3) 写出加入碳酸铵所发生反应的离子方程式:。
写出加入碳酸铵所发生反应的离子方程式:。
(4) CaO2可作供氧剂,写出CaO2与水反应的化学方程式:____________。
(5)CaO2中一般含CaO,某探究小组按下列过程测量CaO2含量:首先称取0.80g样品,然后将样品溶于100mL 1.0mol/L的盐酸中,收集到的气体在标准状况下的体积为112mL,则该样品中CaO2含量为___________。
(6)要配制100mL 1.0mol/L的盐酸,需要12.5mol/L盐酸的体积为______mL;配制该溶液时,除用到量筒、烧杯、胶头滴管外,还需要的玻璃仪器和用品有______________。
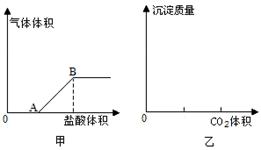
识图绘图是重要的技能。按要求回答下列问题:
(1)向碳酸钠溶液中,逐滴加入盐酸,生成气体的物质的量与加入盐酸体积如甲图所示,则OA段发生反应的离子方程式为________,AB段发生反应的离子方程式为________。
(2)在乙图中补充向澄清石灰水中通入CO2,生成沉淀质量与CO2体积的关系图。