现有A、B、C、D、E五种易溶于水的强电解质,它们由如下离子组成(各种离子不重复)。
| 阳离子 |
H+、NH4+、Mg2+、Ba2+、Al3+ |
| 阴离子 |
OH-、Cl-、HCO3-、NO3-、SO42- |
已知:①0.1 mol/L A溶液的pH <1;②将B溶液分别与其它四种溶液混合,均有白色沉淀生成;
③C溶液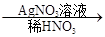 白色沉淀。请回答下列问题:
白色沉淀。请回答下列问题:
(1)写出下列物质的化学式:A______________、B______________。
(2)写出“C溶液 白色沉淀”有关反应的离子方程式____________________________。
白色沉淀”有关反应的离子方程式____________________________。
(3)D、E两种物质中必有一种是_______________,写出将少量该物质的溶液滴加到B溶液中反应的离子方程式___________________________________________________________________。
(4)请你设计实验确定C及另一种未知物各是什么物质。(只许在A~E中选择检验试剂)
| 实验步骤 |
预期现象和结论 |
| 取适量C的溶液于试管中, ① 。 |
预期现象和结论1: ② ; 预期现象和结论2: ③ ; |
(1)Cu(NO3)2的水溶液呈(填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示):;实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以(填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈性,原因是(用离子方程式表示):____________。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的。
物质的量浓度均为0.1mol/L的下列溶液:①KNO3 、②Na2CO3 、③NaHCO3 、④NaHSO4 、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2 ,pH由大到小的顺序为:。
在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g)  3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1) 该反应在30℃时平衡常数K1=,焓变△H0(填“>”、“<”或“=”)。
(2) 该反应在30℃时平衡混合气中C的体积分数为ω1=;从反应开始到达到化学平衡状态时v(A)=____________mol/(L·min)
(3) 该反应在70℃时平衡常数为K2,则 K1K2(填“>”、“=”或“<”)
(4) 可以判断2A(g)+3B(g)  3C(g) 反应已经达到平衡的是( )
3C(g) 反应已经达到平衡的是( )
A.2v(B)=3v(A)
B.密闭容器中总压强不变
C.n(A)∶n(B)∶n(C)=2∶3∶3
D.混合气体的平均相对分子质量不再改变
某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。
请回答:
(1)由I可知X中一定存在的是,步骤I所发生反应的离子方程式为:、。
(2)反应II的化学方程式是。
为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。
(3)由Ⅲ可得出的结论为:。
(4)步骤Ⅳ所得蓝色溶液中阳离子为。
(5)原混合物中各成分的质量之比是。(不必化简)
铅蓄电池是最常见的二次电池,它是由两组平行排列的栅状铅合金极板作为主架,正极板上覆盖PbO2,负极板上覆盖Pb,电解质是硫酸。电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题:
(1)放电时:正极的电极反应式是__________________________;电解液中H2SO4的浓度将变____________;当外电路通过1 mol电子时,理论上负极板的质量增加______________g。
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成____________、在B电极上生成____________,此时铅蓄电池的正负极的极性将_________。