(1)在硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行
次。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、 、 。
(3)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。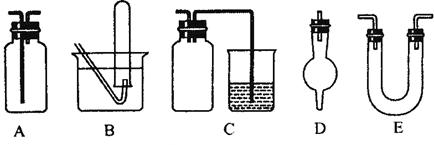
请回答下列问题:
①能用作干燥氨气的装置有_______________(填字母);
②既能用于收集氯气又能用于收集一氧化氮气体的装置有_______________(填字母);
③在实验室制备氯气的实验中,用以除去氯气中氯化氢等杂质气体的装置有________________ (填字母);
④能用于乙烯与溴水反应制二溴乙烷的实验装置有__________(填字母);
⑤在C装置中,若用烧杯内的氢氧化钠溶液吸收尾气二氧化硫,则广口瓶的作用是___________________。
(4)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右图所示的实验。
①可通过观察 来定性的得出结论;
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是 ;
若不采用A同学的改进方案,你认为还可以如何改进? 。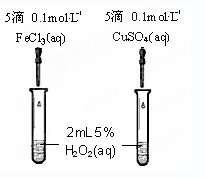
已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用如图所示的装置进行实验。
主要实验步骤如下:
①按照图示组装仪器,并检查装置的气密性
②将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U形管的质量为b g
④从分液漏斗滴入6 mol·L-1的稀硫酸,直到不再产生气体为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U形管的质量为c g
⑦重复步骤⑤和⑥的操作,直到U形管的质量基本不变,为d g
请回答下列问题:
(1)装置中干燥管B的作用是_____________________________________。
(2)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测量的结果将________(填“偏高”、“偏低”或“不变”)。
(3)步骤⑤的目的是________________________________________。
(4)步骤⑦的目的是_______________________________________________。
(5)试样中纯碱的质量分数为________________(用含a、b、d的代数式表示)。
用质量分数为36.5%的盐酸(密度为1.16 g·cm-3)配制1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
| A.5 mL | B.10 mL | C.25 mL | D.50 mL |
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: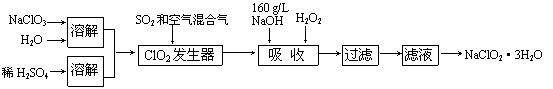
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
请回答下列问题:
(1)发生器中鼓入空气的作用可能是。
(2)吸收塔内反应的化学方程式为。
(3)吸收塔的温度不能超过20℃,原因是。
(4)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是(选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(5)从滤液中得到NaClO2•3H2O晶体的实验操作依次是、、 过滤、洗涤、干燥。
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。下图是化工生产中制备金属钼的实验流程图: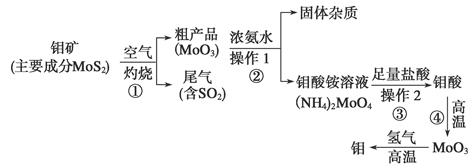
(1)钼酸铵溶液中阳离子的检验方法:________________________________________。
(2)写出反应①的化学方程式:______________________________________________。
(3)反应①的尾气可以用NH3·H2O溶液吸收用于合成肥料,写出反应的离子方程式
______________________________________________________________________。
(4)工厂排放的废水中,金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。处理时首先在酸性条件下用H2O2将Cr3+转化为Cr2O ,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2生成CrOH(H2O)5SO4沉淀。
,再用NaOH调节溶液的pH到8,然后用钠离子交换树脂除去Ca2+和Mg2+,最后通入SO2生成CrOH(H2O)5SO4沉淀。
①H2O2的作用是将溶液中的Cr3+转化为Cr2O ,写出此反应的离子方程式:______________。
,写出此反应的离子方程式:______________。
②常温下,部分阳离子以氢氧化物形式开始沉淀和完全沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
— |
— |
— |
| 完全沉淀时的pH |
3.7 |
11.1 |
8(>9溶解) |
9 |
加入NaOH溶液使溶液呈碱性,Cr2O 转化为CrO
转化为CrO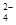 。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
。但溶液的pH不能超过8,此时产生的沉淀是:____________________________________。
③写出上述过程中用SO2作还原剂进行还原的离子方程式______________________。
有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下: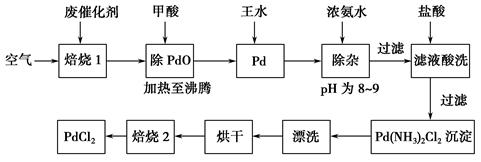
(1)“焙烧1”通入空气的目的是使有机化合物、活性炭等可燃物通过燃烧而除掉,通入空气过多反而不利于实现目的,其原因是。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式:。
(3)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是(写化学式)。
(4)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室检测溶液pH的操作方法是:。
(5)“焙烧2”的目的是:。