在下列溶液中,各组离子一定能够大量共存的是
| A.pH=2的溶液:Fe3+、Cu2+、SO42-、NO3- |
| B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2- |
| C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO- |
| D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl- |
近年来科学家利用合成的方法制备了多种具有特殊结构的有机物,例如具有下列立体结构的环状化合物(其中碳、氢原子均已略去):
有人认为上述有机物中,①立方烷,棱晶烷、金刚烷可以看作是烷烃的同系物;②盆烯是单烯烃;③棱晶烷、盆烯是苯的同分异构体;④金刚烷是癸炔的同分异构体。以上叙述正确的是
| A.③ | B.①和③ | C.②和④ | D.除①外都正确 |
如图是利用一种微生物将废水中的有机物(假设是淀粉)的化学能直接转化为电能,并利用此电能在铁上镀铜,下列说法中正确的是
| A.质子透过离子交换膜由右向左移动 |
| B.铜电极应与X相连接 |
| C.M电极反应式:(C6H10O5)n+7nH2O-24ne-=6nCO2↑+24n H+ |
| D.当N电极消耗0.25 mol气体时,则铁电极增重16 g |
下列操作或装置能达到实验目的的是
进行一氯取代反应后,只能生成三种沸点不同的产物的烷烃是
| A.(CH3)2CHCH2CH2CH3 |
| B.(CH3CH2)2CHCH3 |
| C.(CH3)2CHCH(CH3)2 |
| D.(CH3)3CCH2CH3 |
具有解热镇痛及抗生素作用的药物芬必得主要成分的结构简式为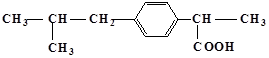 ,它属于
,它属于
①芳香族化合物 ②脂肪族化合物 ③有机羧酸 ④有机高分子化合物 ⑤芳香烃
| A.③⑤ | B.②③ | C.①③ | D.①④ |