下列说法正确的是 ( )
A.12C、13C、14C、金刚石、石墨都是碳元素的同位素
B.同种元素的原子,质量数一定相同
C.互为同位素的原子,质子数一定相同
D.由一种元素组成的物质,一定是纯净物
在甲、乙两烧杯溶液中,共含有大量的Cu2+、K+、H+、NO3-、CO32-、OH-六种子已知甲烧杯中的溶液呈蓝色,则乙烧杯中大量存在的离子组是
| A.Cu2+、K+、H+ | B.K+、CO32-、OH- |
| C.CO32-、OH-、NO3- | D.K+、H+、NO3- |
取100mL1.05 mol·L-1的硫酸注入500mL容量瓶中,加水稀释至刻度线,该混合溶液中硫酸的物质的量浓度是
| A.0.21 mol·L-1 | B.0.42 mol·L- | C.0.56 mol·L-1 | D.0.26 mol·L-1 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.常温常压下,22.4LCO2含有的分子数为1NA |
| B.常温常压下,1.06gNa2CO3含有的Na+离子数为0.02NA |
| C.通常状况下,NA个CO2分子占有的体积约为22.4L |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为1NA |
下列反应中必须加入还原剂才能实现的是
A.Fe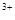 →Fe →Fe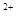 |
B.Zn→ Zn2+ | C.H 2→H2O | D.CuO→CuCl2 |
用下图表示的一些物质或概念间的从属关系中不正确的是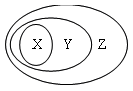
| X |
Y |
Z |
|
| A |
氧化物 |
化合物 |
纯净物 |
| B |
中和反应 |
复分解反应 |
氧化还原反应 |
| C |
胶体 |
分散系 |
混合物 |
| D |
强酸 |
电解质 |
化合物 |