硫酸是一种重要的化工产品,硫酸的消耗量常被视为一个国家工业发达水平的一种标志。目前主要生产方法是“接触法”,有关2SO2+O2 2SO3的说法中,不正确的是
2SO3的说法中,不正确的是
| A.该反应为可逆反应,故在一定条件下SO2和O2不可能全部转化为SO3 |
| B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入2 mol SO2和1 mol O2,则从反应开始到达到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻之后,正、逆反应速率相等 |
| D.平衡时SO2、O2、SO3的分子数之比不再改变 |
将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是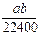
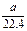
| A. mo1·L-1 | B. mol·L-1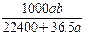 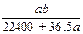 |
C. mol·L-1 | D. mol·L-1 |
下列离子方程式改写成化学方程式正确的是
| A.Cu2++ 2OH- = Cu(OH) 2↓ CuCO3+2NaOH = Cu(OH) 2↓+Na2CO3 |
| B.CO32-+ 2H+= CO2↑十H2O BaCO3+2HCl = BaCl2+CO2↑十H2O |
| C.Ca2++ CO32- = CaCO3↓ Ca(NO3)2+Na2CO3 = CaCO3↓+2NaNO3 |
| D.H++ OH- ="" H2O Ba(OH)2+H2SO4 = BaSO4 ↓十2H |