在2 L密闭容器中,800 ℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)/mol |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |

(1)A点处,v(正)________v(逆),A点正反应速率________B点正反应速率(用“大于”、“小于”或“等于”填空)。
(2)如图中表示NO2的变化的曲线是________。用O2表示从0~2 s内该反应的平均速率v=________________。
(3)能说明该反应已经达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内的密度保持不变
(4)能使该反应的反应速率增大的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂
将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油.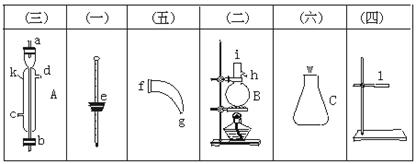
(1)图中A、B、C三种仪器的名称是___________.
(2)将以上仪器按(一) (六)顺序,用字母a,b,c…表示连接顺序:
(六)顺序,用字母a,b,c…表示连接顺序:
e接( )( )接( )( )( )接( )( )接( ).
(3)A仪器中c口是___________,d口是___________(填“进水口”或“出水口”)
(4)蒸馏时,温度计水银球应在___________位置.
(5)在B中注入原油后,加几片碎瓷片的目的是____________________________.
(6)给B加热,收集到沸点60℃~150℃间的馏分是___________,收集到150℃~300℃间的馏分是___________.
已知煤的近代结构模型如图所示:
(1)从煤的结构模型来看,煤是工业上获得___________烃的重要来源.
(2)我国大约70%的煤是直接用于燃烧的,从煤的结构模型来看,在提供热量的同时产生大量的___________等气体物质,造成严重的大气污染.
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%.“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐.下列物质中适宜于做固硫剂的是___________.
| A.氯化钙 | B.氧化钙 | C.硫酸钙 | D.氢氧化钙 |
(4)某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其“固硫”过程.
(5)除上述的“型煤”技术外,为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有___________,___________,___________等.
合成相对分子质量在2000~50000范围内具有确定结构的有机化合物是一个新的研究领域。1993年报道合成了两种烃A和B,其分子式分别为C1134H1146和C1398H1278。B的结构跟A相似,但分子中多了一些结构为 的结构单元。B分子比A分子多了个这样的结构单元(填写数字)。
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸与浓硝酸的混合酸,加入反应器中;
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀;
③在50℃—60℃下发生反应,直至反应结束;
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,然后再用蒸馏水洗涤;
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
填写下列空白:
(1)配制一定比例浓硫酸与浓硝酸混合酸时,操作注意事项是_______________。
(2)步骤③中,为了使反应在50℃—60℃下进行,常用的方法是_____________。
(3)步骤④中洗涤,分离粗硝是苯应使用的仪器是__________________________。
(4)步骤④中粗产品用5%的NaOH溶液洗涤的目的是_______________________。
(5)纯硝基苯是无色,密度比水__________________(填“小”或“大”),具有________
气味的油状液体。
将三种气态烃以任意比例混合,与足量的氧气在密闭容器里完全燃烧,在温度不变的条件下(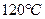 )其压强也不变,推断这三种烃的分子式________,由此可以总结出什么规律?
)其压强也不变,推断这三种烃的分子式________,由此可以总结出什么规律?