下列离子方程式中,正确的是()
A.水玻璃中通入足量的CO2: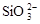 +2CO2+2H2O==H2SiO3↓+2CO +2CO2+2H2O==H2SiO3↓+2CO |
| B.氯化亚铁溶液中通入足量的Cl2:2Fe2++Cl2==2Fe3++2Cl- |
C.NaHCO3溶液中加入足量NaHSO4溶液: 2H++CO ==CO2↑+H2O ==CO2↑+H2O |
| D.NaHCO3溶液中加入过量的Ba(OH)2溶液:2HCO3—+ Ba2+ + 2OH—= BaCO3↓ +2H2O + CO32— |
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr相比较,水的作用不相同的是( )
| A.2Na2O2+2H2O= 4NaOH+O2↑ | B.4Fe(OH)2+O2+2H2O= 4Fe(OH)3 |
| C.2F2+2H2O= 4HF+O2 | D.Cl2 + H2O =" HCl" + HClO |
下列实验操作中,所用仪器合理的是( )
| A.用托盘天平称取25.20gNaCl |
| B.用四氯化碳萃取碘的饱和水溶液中的碘分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出. |
| C.在蒸发皿中放入NaCl溶液,加热、蒸发制取NaCl晶体 |
| D.用100mL容量瓶配制50mL0.1mol/L的盐酸 |
下列逻辑关系图示中正确的是()
下列有关氯水的叙述正确的有()
| A.新制氯水中只有Cl2和H2O分子 |
| B.氯气跟水反应生成两种强酸 |
| C.光照氯水时有气体逸出,该气体是Cl2 |
| D.新制氯水放置数天后酸性会变强 |