下列各组顺序不正确的是
| A.微粒半径大小:S2->Cl->F->Na+>Al3+ |
| B.热稳定性大小:SiH4<PH3<NH3<H2O<HF |
| C.熔点高低:石墨>食盐>干冰>碘晶体 |
| D.沸点高低:NH3>AsH3>PH3 |
某溶液中大量存在以下五种离子:NO3-、SO42-、Fe3+、H+、M,其物质的量浓度之比为c(NO3-):c(SO42-):c(Fe3+):c(H+):c(M)=2:3:1:3:1,则M可能是()
| A.Al3+ | B.Cl- | C.Mg2+ | D.Ba2+ |
已知Na2SO4和NaCl混合溶液中,Cl-的物质的量浓度是Na+的物质的量浓度的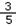 倍,下列叙述中正确的是( )
倍,下列叙述中正确的是( )
| A.Na2SO4和NaCl的物质的量之比为1 :3 |
| B.溶液中一定有1molNa2SO4和3molNaCl |
C.所带电荷数SO42-是Na+的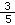 倍 倍 |
D. SO42-与Cl-的物质的量之和等于Na+的物质的量 SO42-与Cl-的物质的量之和等于Na+的物质的量 |
锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:
① 2Sb2S3+3O2+6Fe=Sb 4O6+6FeS ②Sb4O6+6C=4Sb+6CO。关于反应①、②的说法正确的是()
4O6+6FeS ②Sb4O6+6C=4Sb+6CO。关于反应①、②的说法正确的是()
| A.反应①②中的氧化剂分别是Sb2S3、Sb4O6 |
| B.反应②说明高温下Sb的还原性比C强 |
| C.反应①中每生成3 mol FeS时,共转移6 mol电子 |
| D.每生成4 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3 |
能正确表示下列化学反应的离子方程式的是( )
| A.碳酸钙溶于稀盐酸中 CaCO3+2H+=Ca2++H2O+CO2↑ |
| B.氢氧化钡溶液与硫酸反应Ba2++OH-+H++SO42-=BaSO4↓+ H2O |
| C.澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+=Ca2++2H2O |
| D.铜片插入硝酸银溶液中 Cu+Ag+=Cu2++Ag |
5L 1mol/L FeCl3溶液与0.2L 1mol/LKCl溶液中的C(Cl-)之比是()
| A.5 :2 | B.15 :2 |
| C.1 :3 | D.3 :1 |