化学反应N2+3H2  2NH3的能量变化如图所示,该反应的热化学方程式是
2NH3的能量变化如图所示,该反应的热化学方程式是
反应过程()
A.N2(g)+3H2(g) 2NH3(l);ΔH=2(a-b-c) kJ·mol-1 |
B.N2(g)+3H2(g) 2NH3(g);ΔH=2(b-a) kJ·mol-1 |
C.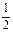 N2(g)+ N2(g)+ 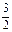 H2(g) NH3(l);ΔH=(b+c-a) kJ·mol-1 H2(g) NH3(l);ΔH=(b+c-a) kJ·mol-1 |
D.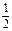 N2(g)+ N2(g)+ 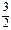 H2(g) NH3(g);ΔH=(a+b) kJ·mol-1 H2(g) NH3(g);ΔH=(a+b) kJ·mol-1 |
下列关于热化学反应的描述中正确的是()
| A.HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热 ΔH=2×(-57.3) kJ/mol |
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) 2CO(g)+O2(g)反应的 2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ/mol |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
应用元素周期律分析下列推断,其中正确的组合是()
①第三周期金属元素最高价氧化物对应的水化物,其碱性随原子序数的增大而减弱
②砹(At)是第ⅦA族元素,其氢化物的稳定性大于HCl
③第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
④铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
| A.①②④ | B.③④ | C.①③④ | D.① |
短周期元素X.Y.Z的原子序数依次递增,它们的原子最外层电子数之和为11,X.Z同主族,Y原子最外层电子数比X原子次外层电子数多1。下列叙述正确的是()
| A.Y的最高价氧化物的熔点比X的最高价氧化物的熔点低 |
| B.原子半径:Y>Z>X |
| C.Y的最高价氧化物的水化物只能与酸反应,不能与碱反应 |
| D.由Z.Y两元素分别形成的单质均存在同素异形体 |
一定条件下,氨气与氟气发生反应:4NH3+3F2  NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是()
NF3+3NH4F,其中NF3分子构型与NH3相似。下列有关说法错误的是()
| A.NF3是极性分子 |
| B.NF3既是氧化产物,又是还原产物 |
| C.NH4F中既含有离子键又含有共价键 |
| D.上述反应中,反应物和生成物均属于分子晶体 |