研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl。下列“水” 电池在海水中放电时的有关说法正确的是( )
| A.正极反应式:Ag+Cl--e-="AgCl" |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na+不断向“水”电池的负极移动 |
| D.AgCl是还原产物 |
实现下列反应需要加入氧化剂的是()
| A.NaOH →Na2CO3 | B.SO2→SO3 | C.H2SO4→H2 | D.CaCO3→CO2 |
在0.5molNa2SO4中含有Na+的数目是()
| A.3.01×1023个 | B.6.02×1023个 | C.0.5个 | D.1个 |
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是 ( )
| A.利用潮汐发电是将化学能转化为电能 |
| B.海水蒸发制海盐的过程中发生了化学变化 |
| C.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg |
| D.海水中含有溴元素,只需经过物理变化就可以得到溴单质 |
右图为铜锌原电池示意图,下列说法正确的是()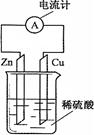
| A.锌片是正极 |
| B.烧杯中溶液逐渐呈蓝色 |
| C.电子由锌片通过导线流向铜片 |
| D.该装置能将电能转变为化学能 |
下列各组中属于同系物的是()
| A.葡萄糖和果糖 | B.甲烷和乙烷 |
| C.16O和18O | D.金刚石和石墨 |