已知图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
N2O4(g)ΔH<0的浓度(c)随时间(t)的变化情况。下列说法正确的是
| A.图一的t2时刻和和图二的t1时刻改变的条件都有可能是升高了温度或增大了压强 |
| B.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将减小 |
| C.图一表示在新条件下达到平衡时,v′(正)>v′(逆),图二表示在新条件下达到平衡时,v′(正)<v′(逆) |
| D.其它条件不变,分别使用不同催化剂上述反应的平衡常数均不变 |
已知可逆反应:2SO2(g) + O2(g)  2SO3(g);△H=-Q1 kJ·mol-1,向密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q2KJ,则下列关系式正确的是
2SO3(g);△H=-Q1 kJ·mol-1,向密闭容器中通入2mol SO2和1mol O2,达到平衡时放出热量Q2KJ,则下列关系式正确的是
| A.Q1=Q2 | B.Q1<Q2 | C.Q1>Q2 | D.无法比较 |
已知在25℃,101kPa下,lgC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是
| A.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(g)△H=-48.40kJ·mol-1 |
| B.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1)△H=-5518kJ·mol-1 |
| C.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1)△H=+5518kJ·mol-1 |
| D.C8H18(1)+22.5O2(g)=8CO2(g)+9H2O(1)△H=-48.40kJ·mol-1 |
在1 L密闭容器中,把1 mol A和1 mol B混合发生如下反应:3A(g)+B(g)  xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是
xC(g)+2D(g),当反应达到平衡时,生成0.4 mol D,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是
| A.x的值为2 | B.A的转化率为40% |
| C.B的平衡浓度为0.8 mol/L | D.D的体积分数为20% |
若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是
| A.Al3+、Na+、NO3-、Cl- | B.K+、Na+、Cl-、NO3- |
| C.K+、Na+、Cl-、AlO2- | D.K+、NH4+、SO42-、NO3- |
铜锌原电池在工作时,下列叙述正确的是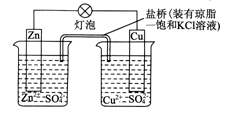
| A.正极反应为:Zn-2e-=Zn2+ |
| B.电池反应为:Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电流从负极流向正极 |
| D.盐桥中的K+移向ZnSO4溶液 |