近年来我国汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:
① N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mo1
② 2C(s)+O2(g)=2CO(g) △H=-221.0kJ/mo1
③ C(s)+O2(g)=CO2(g) △H=-393.5kJ/mo1
尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表:
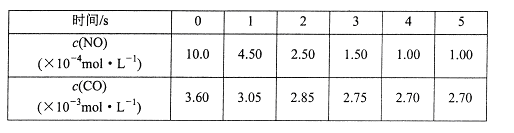
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响);
①前2s内的平均反应速率v(N2)= 。
②在该温度下,反应的平衡常数K= L·mo1-1(写出计算结果)。
③对于该可逆反应,通过综合分析以上信息,至少可以说明 (填字母)
| A.该反应的反应物混合后很不稳定 |
| B.该反应一旦发生将在很短的时间内完成 |
| C.该反应体系达到平衡时至少有一种反应物的百分含量较小 |
| D.该反应在一定条件下能自发进行 |
E.该反应使用催化剂意义不大
(3)为节约能源,减少污染,该研究小组继续探究一种高铁电池,这是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为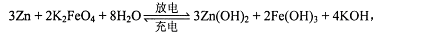
该电池放电时负极反应式为 ,每有1mo1K2FeO4被还原,转移电子的物质的量为 ,充电时阳极反应式为 。
(1)新制氯水中含有的溶质有_____________,放久了的氯水会变为________________,写出变化过程中反应的化学方程式:①_____________________;②________________________。
(2)将新制的氯水分成三份:
①向其中第一份中滴入 溶液,离子方程式是;
溶液,离子方程式是;
②向第二份中滴入 溶液,离子方程式是;
溶液,离子方程式是;
③向第三份中滴入紫色石蕊试液,现象是先___________后_____________。
(3)工业上制取漂白粉的化学方程式是。漂白粉溶于水跟水中的 反应,生成具有漂白性的物质,其化学方程式是。
反应,生成具有漂白性的物质,其化学方程式是。
处于下列状态的物质中:①硫酸钡晶体②干冰③HCl气体 ④铜⑤蔗糖⑥熔融的硝酸钾⑧NaCl溶液 ⑨醋酸
(1)能导电的是(填字母,下同);
(2)属于电解质的是;强电解质;弱电解质;
(3)属于非电解质的是。
A、B、C、D四种芳香族化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料。它们的结构简式如下所示:
请回答下列问题:
(1)写出B中官能团的名称;1mol B能与含______molBr2的溴水反应。
(2)既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有(用A.B.C.D填空)。
(3)按下图C经一步反应可生成E,E是B的同分异构体,则反应①属于反应(填反应类型名称),写出反应②的化学方程式_______________________________________。
(4)同时符合下列两项要求的D的同分异构体有4种
①化合物是1,2——二取代苯;
②苯环上的两个取代基分别为羟基和含有-COO-结构的基团其中两种(G和H)结构简式如下图所示,请补充另外两种。 、 _____________________,
、 _____________________,
(5)写出H与足量NaOH溶液共热反应的化学方程式
________________________________.
(1)某种混合物中可能含有甲酸、乙酸、甲醇及甲酸乙酯这些物质中的一种或几种。在检验时有以下现象:
(Ⅰ)有银镜反应;
(Ⅱ)加入新制 悬浊液,无变澄清的现象;
悬浊液,无变澄清的现象;
(Ⅲ)与含碱的酚酞溶液共热,发现溶液中红色逐渐变浅以至无色。
根据上述现象,可以判断此混合物中一定含有 ,可能含有 ,一定没有 。(填结构简式)
(2)苯氯乙酮是一种具有荷花香味的有机物,其结构简式为:
请回答: 苯氯乙酮的同分异构体有多种,请写出同时符合下列三个条件的所有同分异构体的结构简式:
①分子内有苯环但不含甲基; ②氯原子与链烃基直接相连
③能发生银镜反应。。
(1)若 是某单烯烃与氢气加成后的产物,则烯烃可能有____种结构;若是炔烃与氢气加成的产物,则此炔烃可能有 种结构。
是某单烯烃与氢气加成后的产物,则烯烃可能有____种结构;若是炔烃与氢气加成的产物,则此炔烃可能有 种结构。
(2)已知某有机物的结构简式为:
①该有机物中所含官能团的名称是_______________________________。
②该有机物发生加成聚合反应后,所得产物的结构简式为_____ 。
③写出该有机物发生消去反应的化学方程式(注明反应条件):_________________________________。