处于下列状态的物质中:①硫酸钡晶体 ②干冰 ③HCl气体 ④铜 ⑤蔗糖 ⑥熔融的硝酸钾 ⑧NaCl溶液 ⑨醋酸
(1)能导电的是(填字母,下同) ;
(2)属于电解质的是 ;强电解质 ;弱电解质 ;
(3)属于非电解质的是 。
前四周期元素X、Y、Z、W、N核电荷数依次增加,其中X、Y、Z、W四种元素的核电荷数之和为58;Y 原子的M层p轨道有3个未成对电子;Z与Y同周期,且在该周期中电负性最大;W原子的L层电子数与最外层电子数之比为4∶1,其d轨道中的电子数与最外层电子数之比为5∶2;N3+的价电子排布式为3d5。
(1)X的元素符号为,N元素在元素周期表中的位置
(2)Y与X形成共价化合物A,Z与X形成共价化合物B,A与B还原性较强的是(写分子式)
(3)含W元素的最高化合价的含氧酸根离子是,该含氧酸根离子在分析化学中有重要作用,请写出在酸性条件下该含氧酸根离子与NSO4溶液反应的离子方程式:。
(4)W的某黑色氧化物常于实验室制取Z单质,写出该反应的化学方程式
(5)元素N的核电荷数是另一种元素Q的2倍,则Q单质与烧碱溶液反应的化学方程式为
向反应后的溶液中,通入足量CO2,反应的离子方程式为
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素
| a |
b |
c |
d |
e |
|||||||||||||
| f |
g |
h |
i |
j |
|||||||||||||
| k |
m |
||||||||||||||||
试回答下列问题:
(1)d的基态原子电子排布图为;k的外围电子排布式为
(2)ci2的结构式为;ci2与ce2比较,沸点较低的是(写化学式)
(3)m的晶体的晶胞如图所示,则一个晶胞中m原子的个数个。每一个m周围有个M与其相邻且距离相等。
(4)根据等电子体原理,写出与d2互为等电子体的粒子、(写化学式)
(5)下列关于元素在元素周期表中的位置的叙述正确的是。
A.m位于元素周期表中第四周期、ⅡB族,属于ds区元素;
B.k位于元素周期表中第四周期、ⅣB族,属于d区元素;
C.g位于元素周期表中第三周期、ⅡA族,属于s区元素;
D.j位于元素周期表中第三周期、ⅦA族,属于ds区元素;
(6)将氨水逐滴滴入到m的硫酸盐溶液中,直至过量,现象,若加入极性较小的溶剂乙醇,现象。写出反应过程中总的离子方程式。
下图表示一些晶体中的某些结构,它们分别是干冰、CsCl、NaCl、石墨、金刚石结构中的某一种的某一部分。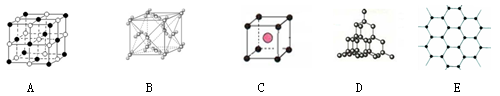
(1)代表石墨是;每一层内碳原子数与C—C化学键之比是。
(2)上述B、C、D三种物质熔点由高到低的排列顺序为。(用字母表示)
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO、FeO的晶体结构类型均与氯化钠的相同,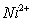 和
和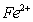 的离子半径分别为69pm和78pm,则熔点NiOFeO(填“<”或“>”)。
的离子半径分别为69pm和78pm,则熔点NiOFeO(填“<”或“>”)。
(4)某氮铝化合物X具有耐高温、抗冲击、导热性好等优良性质,广泛用于陶瓷工业等领域。工业上用氮气、氧化铝和碳在一定条件下反应生成CO和X (X的晶体结构如图所示),X晶体中Al原子的配位数为,工业制备 X 的化学方程式为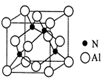
有下列晶体,回答下列问题
①C60 ②NaOH ③H2O2 ④Na2O2 ⑤NH4Cl
⑥CO2 ⑦C2H2 ⑧SiO2⑨晶体氖 ⑩铁
(1)属于分子晶体的是(2)属于原子晶体的是
(3)属于离子晶体的是(4)固体可以导电的晶体是
(5)含有极性共价键的非极性分子是
回答下列问题:
(1)指出配合物K3[Co(CN)6]中的中心离子、配体和配位数 :、、
(2)试比较下列含氧酸的酸性强弱(填“>”、“<”或“=”)
H3PO4H3PO3; HClO4H2SO4
(3)N2H4与H2O2反应:N2H4(l)+2H2O2=N2(g)+4H2O(g),H2O2的电子式为,N2H4的电子式为;N2H4分子中N原子的杂化方式,若该反应中有4 mol N—H键断裂,则形成 键有mol和形成
键有mol和形成 键有mol。
键有mol。