某研究性学习小组用不纯的氧化铝(杂质为Fe2O3)为原料,设计了冶炼铝的以下工艺流程(部分反应产物没有标出):
(1)试剂X的化学式为 ,反应Ⅰ的离子方程式是 。实验室配制480mL 1 mol·L-1 X的溶液必须用到玻璃仪器除烧杯、玻璃棒、试剂瓶、胶头滴管外,还有 。常用来可以标定所配X的溶液浓度是否准确的实验名称是 。
(2)按照方案设计,试剂Z的作用是调节溶液的pH,以生成沉淀b[Fe(OH)3]。从试剂工业的角度,你认为方案 更合理,理由是 。
(3)已知N为氨气,实验室中还可以用下图装置制取氨气并进行氨气喷泉实验。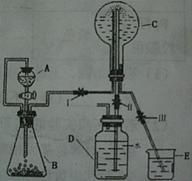
①仪器A的名称是 ,装置中A口部和B口部之间联通导气管的作用是 。
②若用此装置制备N气,若A中盛有浓氨水,则B装置中的固体试剂不可以选用下列的 (填字母序号)。
a.生石灰 b.烧碱 c.胆矾 d.碱石灰
(4)室温下,在a mol·L-1的(NH4)2SO4水溶液中pH=5,存在着平衡NH4++H2O  NH3·H2O+H+,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
NH3·H2O+H+,则该平衡常数的表达式为 (用含代数a的较为精确地数字表达式表示,不必化简,不做近似运算)。
同学想通过下图所示装置(夹持装置已略去)进行实验,研究推断SO2与Na2O2反应的产物。
回答下列问题:
(1)装置B的作用___________________________________________________。
装置D除了吸收过量的SO2外还有什么作用___________________________。
(2)如何检验反应中是否有O2生成______________________________________。
(3)假如Na2O2已反应完全,为确定C中固体产物的成分,甲设计如下实验:
得出结论:产物是Na2SO4.
该方案是否合理____________(填是或否),理由是_____________________-。
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
请填写下列空白:
(1)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,步骤③和步骤⑥该步骤的实验操作名称分别是是。
(2)步骤①灼烧海带时,除需要三脚架、泥三角外,还需要用到的实验仪器是
| A.烧杯 | B.表面皿 | C.坩埚 | D.酒精灯 E.干燥器 |
(3)步骤⑥是从含碘苯溶液中分离出单质碘和回收苯,还需经过蒸馏,指出下列实验装置中的错误之处。
①
②
③
(4)进行上述蒸馏操作时,使用水浴的原因是①;
最后晶态碘在②里聚集。
(5)步骤④反应的离子方程式是。
步骤④中的转化还可以Cl2或双氧水(H2O2),请分别写出反应的离子方程式:,
。
(6)步骤⑤中,某学生选择用苯来提取碘的理由是。
(7)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:。
色谱分析法是现代分离实验技术中的一种,试回答下列问题:
(1)已知两种有机色素A 与B混合在一起,经测定知A的极性比B强,则下列说法正确的是_________
A. 用溶解过滤法,B不溶A溶于水
B. 用重结晶法,A在水中的溶解度比B大
C. 用蒸馏法,因为A的熔沸点高
D. 用纸层析法,丙酮为展开剂,下端为A,上端为B
(2)纸层析法的原理是_________
A.萃取原理 B. 毛细现象 C. 蒸馏原理 D. 极性相似相溶原理 E.过滤
(3)在用纸层法进行层析操作时,为什么不能让滤纸上的试样点接触展开剂?__________。
实验室制取乙酸乙酯的主要步骤如下:
①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按右图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min。
③待试管乙收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置待分层。④分离出乙酸乙酯层、洗涤、干燥。
(1)反应中浓硫酸的作用是___________________写出制取乙酸乙酯的化学方程式:___________________________________;
(2)上述实验中饱和碳酸钠溶液的作用是(填字母):_______________。
| A.中和乙酸和乙醇。 |
| B.中和乙酸并吸收部分乙醇。 |
| C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出。 |
| D.加速酯的生成,提高其产率。 |
(3)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有__________;分离时,乙酸乙酯应该从仪器 ________(填:“下口放” 或“上口倒”)出。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____。
②试管C置于冰水浴中的目的是_____________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在______层(填上或下),分液后用_________ (填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4C.Na2CO3溶液
②再将环己烯按下图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,实验制得的环己烯精品质量低于理论产量,可能的原因是____________________
A.蒸馏时从70℃开始收集产品
B.环己醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点