碘盐的主要成分是KIO3和NaCl,KIO3在工业上可用电解法制取,以石墨和铁为电极,电解KI溶液,反应方程式为KI+3H2O=KIO3 +3H2↑。下列有关说法中正确的是
| A.电解时,石墨作阴极,铁作阳极 |
| B.电解时,在阴极上产生KIO3 |
| C.电解后电解质溶液pH变大 |
| D.电解中每转移0.6mol e-,理论上可得到0.1mol无水KIO3晶体 |
对于mA(s) + nB(g) 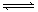 eC(g) + f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如右下图,下列叙述正确的是
eC(g) + f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)和压强(P)的关系如右下图,下列叙述正确的是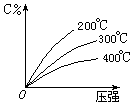
| A.达到平衡后,加入催化剂,则C%增大 |
| B.达到平衡后,若升温,平衡逆向移动 |
| C.化学方程式中n<e +f |
| D.达到平衡后,增加A的量,平衡正向移动 |
甲、乙两容器中都在进行A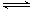 B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是
B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是
| A.甲快 | B.乙快 | C.相等 | D.无法确定 |
反应C(s)+H2O(g)  CO(g) + H2(g) 在一可变容积的密闭容器中进行,下列条件的改变能使瞬间正反应速率增大的是
CO(g) + H2(g) 在一可变容积的密闭容器中进行,下列条件的改变能使瞬间正反应速率增大的是
| A.增加碳单质的量 |
| B.保持体积不变,充入N2使体系压强增大 |
| C.将容器的体积缩小一半 |
| D.保持压强不变,充入N2使体系体积增大 |
反应2SO2+O2 2SO3经a min后,SO3浓度的变化情况如图所示,在时间0--a min内用O2表示的平均反应速率为0.04mol/(L ·min),则a等于
2SO3经a min后,SO3浓度的变化情况如图所示,在时间0--a min内用O2表示的平均反应速率为0.04mol/(L ·min),则a等于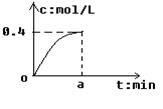
| A.0.1 | B.2.5 | C.5 | D.10 |
下列有关反应能量变化图像的判断错误的是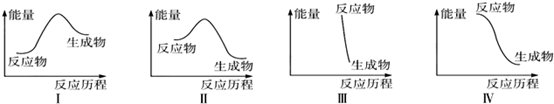
| A.I可表示需加热的放热反应 | B.Ⅱ可表示需加热的放热反应 |
| C.Ⅲ可表示爆炸反应 | D.Ⅳ可表示酸和碱的中和反应 |