甲、乙两容器中都在进行A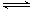 B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是
B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是
| A.甲快 | B.乙快 | C.相等 | D.无法确定 |
下列“反应”中不是化学变化的是()
| A.显色反应 | B.焰色反应 | C.颜色反应 | D.水解反应 |
下列物质与氧气反应,生成氧化物的种类最少的是()
| A.Li | B.Na | C.K | D.Rb |
在自然界中大量存在的钠的化合物是()
| A.NaOH | B.Na2O | C.NaCl | D.Na2O2 |
下列关于钠的说法不正确的是()
| A.金属钠和氧气反应,条件不同,产物不同 |
| B.钠钾合金通常状况下呈液态,可作原子反应堆的导热剂 |
| C.钠的化学活泼性很强,少量的钠可保存在有机溶剂CCl4中 |
| D.钠比较活泼,但是它不能从溶液中置换出金属活动顺序表中钠后面的金属 |
下列关于Na2O2的叙述正确的是( )
| A.Na2O2是淡黄色固体,久置于空气中变成Na2O |
| B.Na2O2与水的反应中,Na2O2只作氧化剂 |
| C.用Na2O2漂白过的织物、麦杆等日久又渐渐变成黄色 |
| D.Na2O2放入饱和NaOH溶液中,放出大量的O2,并有白色固体析出 |