某研究性学习小组探究铁粉与水蒸气反应后的固体的组成,铁粉与水蒸气反应的化学方程式为 。
基于上述反应所得黑色固体粉末,研究性学习小组提出下列假设并欲做实验分析。
假设一:固体全部是Fe3O4
假设二:固体全部是Fe
假设三:固体是
取铁粉与水蒸气反应后的固体作为样品,进行如下实验探究。
探究1:取少量样品投入硫酸铜稀溶液中,若现象为 ,则假设一成立。
探究2:取1.68g样品在纯氧中灼烧后,若质量为 g,则假设二成立。
经过实验探究,假设一、二都不成立。
探究3:取样品4.00g进行如下实验。
B中的溶液是 ;实验后经测定样品完全反应,D中剩余固体质量为3.36g,且测得E中沉淀质量为6.0g,则样品中Fe3O4的质量分数为 ;实验装置中有一明显缺陷是 。
(14分)某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。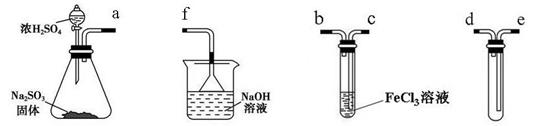
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在________中,再加水稀释。
(2)组装仪器按气流方向正确的连接顺序是a接____,____接____,____接____。
(3)烧杯中倒置漏斗的作用是______________________________________。
(4)往FeCl3溶液中通入足量SO2时,观察到的现象为_______________________。
(5)根据以上现象,该小组同学认为SO2与FeCl3溶液发生了氧化还原反应。
①写出SO2与FeCl3溶液反应的离子方程式:___________________________;
②请设计实验方案检验有Fe2+生成:__________________________________;
③该小组同学向盛装FeCl3试管反应后的溶液中加入硝酸酸化的BaCl2溶液,若出现白色沉淀,即可证明反应生成了SO42-。该做法不合理,理由是_________________
某学生对Na2SO3与AgNO3在不同PH下的反应进行探究。
(1)测得Na2SO3溶液PH=11,AgNO3溶液PH=5,二者水解的离子分别是。
(2)调节PH,实验记录如下:
查阅资料得知:
i.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
ii.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是。
②推测a中白色沉淀为Ag2SO4,推测的依据是。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于溶液中,未溶解。
(4)将中滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是。
②根据上述现象,分析X的性质和元素组成是。
③Ⅱ中反应的化学方程式是。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如下: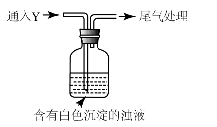
①气体Y是。
②白色沉淀转化为X的化学方程式是。
(12分)实验室制取少量溴乙烷的装置如右图所示。
根据题意完成下列填空: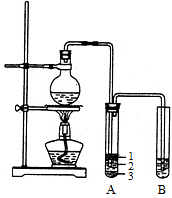
(1)圆底烧瓶中加入的反应物是溴化钠、和1:1的硫酸。配制体积比1:1的硫酸所用的定量仪器为(选填编号)。
a.天平 b.量筒 c.容量瓶d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是。试管A中的物质分为三层(如图所示),产物在第层。
(4)试管A中除了产物和水之外,还可能存在、(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是(选填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:。
(16分)为探究苯与溴的取代反应,甲用如图装置Ⅰ进行如下实验:
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑,3~5 min后发现滴有AgNO3的锥形瓶中有浅黄色的沉淀生成,即证明苯与溴发生了取代反应.
(1)装置I中①的化学方程式为_________________,_______________
②中离子方程式为_________________________________.
(2)①中长导管的作用是_______________________________________________.
(3)烧瓶中生成的红褐色油状物,要想得到纯净的产物,可用_____________试剂洗涤.洗涤后分离粗产品应使用的仪器是____________________.
(4)乙同学设计如图所示装置Ⅱ,并用下列某些试剂完成该实验.可选用的试剂是:苯;液溴;浓硫酸;氢氧化钠溶液;硝酸银溶液;四氯化碳.
a的作用是__________________________________________________________.
b中的试剂是________________________________________________________.
某研究性学习小组,利用固体Na2SO3与中等浓度的H2SO4反应,制备SO2气体并进行有关性质探究实验。该反应的化学方程式为:Na2SO3(固)+H2SO4=Na2SO4 + SO2↑+H2O。除固体Na2SO3和中等浓度的H2SO4外,可供选择的试剂还有:
①溴水②浓H2SO4③品红试液④紫色石蕊试液⑤澄清石灰水⑥NaOH溶液
回答下列问题:
(1)欲验证SO2的漂白作用,应将SO2气体通入中(填物质编号),观察到的现象是;
(2)欲验证SO2的还原性,应将SO2气体通入中(填物质编号),观察到的现象是;
(3)为说明SO2的氧化性,通常利用的反应是(写化学反应方程式);
(4)为防止多余的SO2气体污染环境,应将尾气通入中(填物质编号),
反应离子方程式为;
(5)有一实验小组发现,SO2产生缓慢(不考虑SO2在溶液中的溶解,实验中也不存在漏气、反应温度等装置和操作上的问题),请你推测可能的原因(至少填写一种):
①,②。