乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
2CO(g) + 4H2(g) CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
CH3CH2OH(g) + H2O(g) △H =" —256.1" kJ·mol-1
已知:CO(g) + H2O(g) CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
CO2(g)+H2(g) △H=" —41.2" kJ·mol-1
(1)以CO2(g)与H2(g)为原料也可合成乙醇,其热化学方程式如下:
2CO2(g) +6H2(g) CH3CH2OH(g) +3H2O(g) △H = 。
CH3CH2OH(g) +3H2O(g) △H = 。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。
①某研究小组在实验室以Ag– ZSM– 5为催化剂,测得NO转化为N2的转化率随温度变化情况如下图。若不使用CO,温度超过800℃,发现NO的转化率降低,其可能的原因为 ;在n(NO)/n(C O)=1的条件下,应控制的最佳温度在 左右。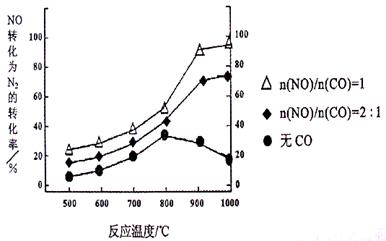
②用活性炭还原法处理氮氧化物。有关反应为:C (s) +2NO2(g) N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g) + CO2 (g)。某研究小组向某密闭容器中加人足量的活性炭和NO,恒温( T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
| 浓度/mol∙L-1 时间/min |
NO |
N2 |
CO2 |
| 0 |
1.00 |
0 |
0 |
| 20 |
0.40 |
0.30 |
0.30 |
| 30 |
0.40 |
0.30 |
0.30 |
| 40 |
0.32 |
0.34 |
0.17 |
| 50 |
0.32 |
0.34 |
0.17 |
I.根据表中数据,求反应开始至20min以v(NO)表示的反应速率为 (保留两位有效数字),T1℃时该反应的平衡常数为 (保留两位有效数字)。
II.30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 。下图表示CO2的逆反应速率[v逆(CO2)]随反应时间的变化关系图。请在图中画出在30min改变上述条件时,在40min时刻再次达到平衡的变化曲线。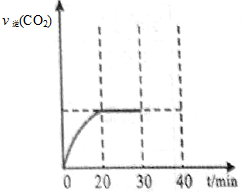
有一硫酸与硝酸的混合溶液100 ml,取出10 mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0 mol•L-1NaOH溶液反应,用去35 mL碱液时恰好完全中和。试求:原混合液中H2SO4的物质的量浓度是多少?HNO3的物质的量是多少?
9.6g铜与100mL质量分数为98%,密度为1.84g·cm-3的H2SO4在加热下发生如下反应:
2H2SO4(浓)+Cu△CuSO4+SO2↑+2H2O,已知铜反应完全。计算:
(1)原H2SO4的物质的量浓度。
(2)被还原的H2SO4的物质的量及生成的气体在标准状况时的体积(保留2位小数)。 (备注:要求写出计算过程,只写结果不得分)
计算题:(要求写出计算过程)现有一定温度下的密闭容器中存在如下反应:
2SO2 (g) + O2(g)  2SO3(g)
2SO3(g)
已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态,若未达到,哪个方向进行?
(2)达平衡状态时, SO2的转化率应为多少?
为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,待合金完全溶解后,收集到6.72L(标准状况)NO和NO2的混合气体,并测得溶液中H+浓度为1mol/L。假设反应后溶液的体积仍为80mL,试计算.
(1)被还原硝酸的物质的量。(2)合金中银的质量分数。
有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol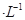 NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取l0mL原混合液,加入3.2g铜粉共热时,在标准状况下收集到气体的体积为多少升?(保留两位有效数字。)