为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,待合金完全溶解后,收集到6.72L(标准状况)NO和NO2的混合气体,并测得溶液中H+浓度为1mol/L。假设反应后溶液的体积仍为80mL,试计算.
(1)被还原硝酸的物质的量。 (2)合金中银的质量分数。
黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000 g样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL 。
已知:SO2 + 2Fe3+ + 2H2O ="=" SO2- + 2Fe2+ + 4H+
Cr2O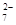 + 6 Fe2+ + 14 H+ ="=" 2 Cr3+ + 6 Fe3+ + 7 H2O
+ 6 Fe2+ + 14 H+ ="=" 2 Cr3+ + 6 Fe3+ + 7 H2O
⑴.样品中FeS2的质量分数是(假设杂质不参加反应)________________。
⑵.若灼烧6 g FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03 kJ热量,写出SO3气体转化为H2SO4的热化学方程式:____________________________________。
⑶.煅烧10 t上述黄铁矿,理论上产生SO2的体积(标准状况)为_______________L,制得98%的硫酸质量为__________ t ,SO2全部转化为H2SO4时放出的热量是_______ kJ。
今有Na2CO3、NaHCO3、NaCl组成的混合物100g,加热到质量不再减少为止。剩余残渣为84.5g,将残渣溶于水,滴入足量的AgNO3溶液得到白色沉淀,加足量的稀硝酸后大部分沉淀消失,剩余沉淀为12.26g,试计算混合物中Na2CO3、NaHCO3、和NaCl的质量分数各是多少?
向100g8%的NaOH溶液中通入一定量的CO2,然后将溶液在低温下蒸干,所得固体的可能成分填入下表:
| ⑴ |
⑵ |
⑶ |
⑷ |
如果最后得到的固体质量为13.7g,则标准状况下通入的CO2的质量是多少?
Fe和Al是两种常用的金属,现将它们按一定的质量比组成均匀的混合物。
(1)取一定质量的该混合物,向其中加入足量的NaOH溶液,生成气体的体积在标准状况下为n L,则反应的离子方程式为。
混合物中Al的物质的量为(用含字母的数学式表示)。
(2)另取相同质量的该混合物,向其中加入足量的稀硫酸,固体全部溶解,生成气体的体积在标准状况下为mL,则反应中转移电子的物质的量为,混合物中Fe的质量为(用含字母的数学式表示)。
“汽车尾气污染”已备受世人关注。汽车内燃机中,汽油汽化后与空气按一定比例混合进入汽缸,被引擎用电火花点燃。燃烧使汽缸内温度迅速升高,气体体积急剧膨胀,由此产生的压力推动活塞运动。燃烧时产生的有害气体通过尾气排出,造成大气污染。为简化讨论,以辛烷(C8H18)代表汽油的成分,并设空气中O2占1/5体积。请回答下列问题:
(1)设辛烷气与空气的体积比(相同条件下)为a,要使辛烷完全燃烧,a的最小值为(用小数表示,设此最小值为a′)________。
(2)若辛烷气与空气的体积比大于a′则尾气所含污染大气的有害气体中相对含量会增多的是(写分子式)________。
(3)若辛烷气与空气的体积比小于a′,则尾气所含污染大气的有害气体中相对含量会增多的是(写分子式)________,产生这种气体的反应方程式是__________________________。