NA为阿伏加德罗常数的数值,下列叙述正确的是
| A.22.4L NH3中含氮原子数为NA |
| B.1 mol Na2O2与水完全反应时转移的电子数为NA |
| C.1 L 0.1mol·L-1碳酸钠溶液的阴离子总数等于0.1 NA |
| D.1 mol O2和2 mol SO2在密闭容器中充分反应后的分子数等于2NA |
在aLAl2(SO4)3和(NH4)2SO4的混合溶液中加入bmol的BaCl2,恰好使溶液中的SO42-完全沉淀;如加入足量强碱并加热可得到cmolNH3,则原溶液中的Al3+的浓度(mol/L)为
A.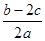 |
B. |
C. |
D. |
NA代表阿伏加德罗常数,下列叙述正确的是
| A.在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 |
| B.10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| C.一定温度下,1molFeCl3水解生成NA个Fe(OH)3胶体颗粒 |
| D.在标准状况下,2.24L苯中所含分子数约为NA |
下列物质的分类正确的是()
| 混合物 |
非电解质 |
碱 |
酸式盐 |
|
| A |
漂白粉 |
Cl2 |
氨水 |
NaHCO3 |
| B |
福尔马林 |
苯 |
Cu2(OH)2CO3 |
明矾 |
| C |
胆矾 |
SO2 |
纯碱 |
NH4Cl |
| D |
食醋 |
C2H5OH |
苛性钾 |
NaHSO4 |
当光束通过下列分散系时,能观察到丁达尔效应的是
| A.蒸馏水 | B.稀H2SO4 | C.CuSO4溶液 | D.Fe(OH)3 胶体 |
0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-浓度比为
| A.15∶2 | B.1∶1 | C.3∶1 | D.1∶3 |