2010年上海世博会上太阳能光伏发电系统是被称为“21世纪绿色光源”的半导体照明(LED)系统(如图)。已知发出白光的LED是将GaN芯片和钇铝榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成。下列说法中不正确的是
A、光伏发电是将太阳能转变为电能
B、图中N型半导体为负极,P型半导体为正极,电流从a流向b
C、YAG中钇显+3价
D、Ga与N在元素周期表中不处于同一主族
已知X、Y、Z、W是原子序数依次增大的短周期元素,这些元素的其他信息如下表。下列说法正确的是
| 元素 |
信息 |
| X |
K层电子数是L层电子数的2倍 |
| Y |
一种核素在考古时常用来鉴定一些文物的年代 |
| Z |
所处的周期序数与族序数相等 |
| W |
最高价氧化物对应的水化物酸性最强 |
A.W的阴离子半径大于Z的阳离子半径
B.Y的氢化物比W的氢化物稳定
C.Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物
D.X在氧气中加热反应生成X2O2
已知:25 ℃时,CaCO3的Ksp=2.8×10-9,CaCO3在水中的溶解平衡曲线如图所示。下列说法正确的是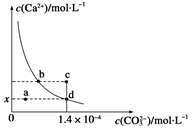
| A.x数值为1.4×10-5 |
| B.b点与d点对应的溶度积相等 |
| C.加入蒸馏水可使溶液由d点变到a点 |
| D.c点将有沉淀生成,平衡后溶液中c(Ca2+)、c(CO32-)一定相等 |
下列实验操作正确且能达到预期目的的是
| 实验目的 |
操作 |
|
| A |
比较水和乙醇中羟基氢的活泼性强弱 |
用金属钠分别与水和乙醇反应 |
| B |
欲证明CH2=CHCHO中含有碳碳双键 |
滴入酸性KMnO4溶液,看紫红色是否褪去 |
| C |
确定碳、氯两元素非金属性的强弱 |
测定同温同浓度的Na2CO3和NaClO水溶液的pH |
| D |
欲除去苯中混有的苯酚 |
向混合液中加入浓溴水,充分反应后,过滤 |
下列有关物质的性质和应用叙述正确并且有因果关系的是
| A.烧碱具有碱性,能用于治疗胃酸过多 |
| B.焦炭具有还原性,一定条件下能将二氧化硅还原为硅 |
| C.浓硝酸具有强氧化性,能和浓氨水反应产生白烟 |
| D.二氧化硫具有漂白性,与氯水混合使用漂白效果更好 |
含有下列各组离子的溶液中,通入过量SO2气体后仍能大量共存的是
| A.H+、Ca2+、Fe3+、NO3- | B.Ba2+、ClO-、Na+、OH- |
| C.Na+、NH4+、I-、HS- | D.Na+、Ca2+、K+、Cl- |