工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
下图装置Ⅰ是实验室制乙酸乙酯的常用装置: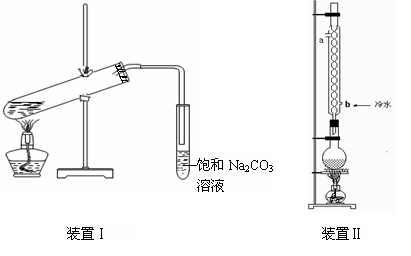
实验中所用的某些试剂及产物的相关数据如下:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
||
| 乙醇 |
-114 |
78 |
0.789 |
||
| 乙酸 |
16.6 |
117.9 |
1.05 |
||
| 乙酸乙酯 |
-83.6 |
77.5 |
0.900 |
||
| 98%H2SO4 |
10 |
338 |
1.84 |
回答下列问题:
(1)如果用CH3CO18OH与CH3CH2OH反应,写出该反应的化学方程式 ,浓H2SO4的作用是 。
(2)要从装置Ⅰ中右侧小试管中分离出乙酸乙酯,应进行的操作是:撤出小试管,将混合液倒入 (填仪器名称),用力振荡,静置, (填现象),然后将产物从_____口(填“上”或“下”)倒出。
(3)采用装置Ⅱ可提高乙酸乙酯的产率,结合表格中的数据,说明该装置可提高乙酸乙酯产率的原因: 。
在开展研究性学习活动中,某研究小组的同学设计了如下3套实验装置,用来收集和验证铁在高温下与水蒸气反应的气体产物。 (1)请指出能正确得出实验结论的装置(填"A"、"B"或"C")。
(1)请指出能正确得出实验结论的装置(填"A"、"B"或"C")。
(2)写出铁在高温下与水蒸气反应的化学方程式。
(3)怎样用简单方法检验收集到的气体,简述检验操作的方法和现象。
三草酸合铁酸钾晶体K3[Fe(C2O4 )3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0mol·L-1HNO3、1.0mol·L-1盐酸、1.0mol·L-1 NaOH、3%H2O2、0.1mol·L-1KI、0.1mol·L-1CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是,现象是
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:;假设2:;假设3:。
②设计实验方案证明你的假设(不要在答题卡上作答)
③实验过程
根据②中方案进行实验。在答题卡上按下表的格式写出实验步骤、预期现象与结论。
| 实验步骤 |
预期现象与结论 |
| 步骤1: |
|
| 步骤2: |
|
| 步骤3: |
|
| …… |
(16分).某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: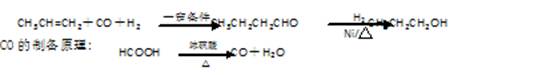
请填写下列空白:
(1)实验室现有锌粒、稀硝酸、稀盐酸、浓硫酸,2-丙醇,从中选择合适的试剂制备氢气、丙烯,写出化学反应方程式:、;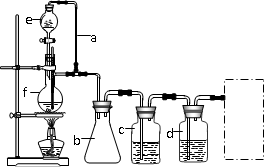
(2)若用以上装置制备干燥纯净的CO,装置中a和b的作用分别是、;c和d中盛装的试剂分别是,;若用以上装置制备H2,气体发生装置中必需的玻璃仪器e、f名称是、;在虚线框内画出收集干燥H2的装置图。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是。(填序号)
①饱和Na2SO3溶液②酸性KMnO4溶液③石灰水④无水CuSO4⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:
①R-CHO+NaHSO3 (饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34°C,1-丁醇118°C,并设计出如下提纯路线:
试剂1为;操作1为;操作2为;操作3为。
某校化学课外小组的学生为了验证乙醇的分子结构,设计如下实验程序:乙醇的精制、乙醇组成元素的测定、分子式的测定、分子结构的测定。
(1)若所用乙醇中含少量水,采用直接蒸馏的方法不能有效除去水,通常向其中加入,然后蒸馏。证明乙醇不再含水,可用一种试剂检验,这种试剂是。
(2)用燃烧乙醇分析产物的方法确定含有C、H、O三种元素。
a.证明含有H元素的操作是。
b.证明含有O元素时,需取得的实验数据是:CO2的质量,H2O的质量及。
(3)为确定乙醇的分子式,在通过(2)获取乙醇的实验式之后,是否必须再测定乙醇的相对分子质量才能确定其分子式(答“是”或“否”),理由是。
(4)测定乙醇的分子结构
a.若采用红外光谱仪测定,则通过所得红外光谱中有键的振动吸收峰,即可确定乙醇的结构是CH3CH2OH而不是CH3OCH3。(填“C—H”,“C—C”,“C—O”,“O—H”)
b.若采用核磁共振仪测定,则所得乙醇的核磁共振氢谱上应有个吸收峰。