根据下列实验现象得出的结论,正确的是
| 选项 |
实验现象 |
结论 |
| A |
某气体能使润湿的淀粉碘化钾试纸变蓝 |
该气体一定是氯气 |
| B |
向某溶液中加入盐酸酸化的BaCl2,有白色沉淀生成 |
该溶液中一定存在SO42- |
| C |
铁与稀硝酸充分反应后,溶液呈浅绿色 |
稀硝酸与铁反应只能生成Fe2+ |
| D |
SO2通入溴水中,溴水褪色 |
SO2具有还原性 |
相同容积的四个密闭容器中进行同样的可逆反应:2A(g)+B(g)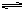 3C(g)+2D(s),起始时四个容器所盛A、B的物质的量分别为:
3C(g)+2D(s),起始时四个容器所盛A、B的物质的量分别为:
| 甲 |
乙 |
丙 |
丁 |
|
| A/mol |
2 |
1 |
2 |
1 |
| B/mol |
1 |
1 |
2 |
2 |
在相同温度下建立平衡时,A或B的转化率大小关系正确的是()
A.A的转化率:甲<丙=乙<丁 B.A的转化率:甲<乙<丙=丁
C.A的转化率:甲=丙<乙<丁 D.B的转化率::丁<乙<丙<甲
某同学为检验某溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是( )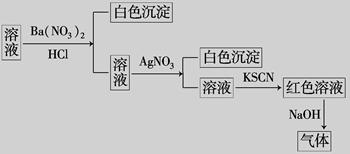
| A.原溶液中一定含有SO | B.原溶液中一定含有NH |
| C.原溶液中一定含有Cl- | D.原溶液中可能含有Fe3+ |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为
CO(g)+ H2O(g) CO2(g) + H2(g)△H <0
CO2(g) + H2(g)△H <0
反应达到平衡后,为提高CO的转化率,下列措施中正确的是()
A 增加压强 B更换催化剂C增大CO 的浓度 D降低温度
已知某温度下蒸馏水中的c(H+)=1×10-6mol/L,在此温度下将甲酸和氢氧化钠溶液混合,所得溶液的pH=7,此溶液中()
| A.c(HCOO-)<c(Na+) | B.c(HCOO-)>c(Na+) |
| C.c(HCOO-)=c(Na+) | D.无法确定c(HCOO-)与c(Na+)的关系 |
使用一种试剂,可以把KCl、AlCl3、Ba(NO3)2、CH3COOH四种溶液区别开来,所用试剂为()
| A.NaOH | B.BaCl2 | C.Na2CO3 | D.AgNO3 |