设NA为阿伏伽德罗常数的值。下列说正确的是
| A.高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3NA |
| B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA |
| C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA |
D.5NH4NO3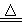 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA 2HNO3+4N2↑+9H2O反应中,生成28g N2时,转移的电子数目为3.75NA |
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是()
| A.装置①常用于分离互不相溶的液体混合物 |
| B.装置②可用于吸收氨气,且能够防止倒吸 |
| C.装置③可用于制备少量NH3 |
| D.装置④可用于收集O2 |
下列离子方程式正确的是()
| A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
下列叙述不正确的是()
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③第ⅠA、ⅡA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤沸点:NH3<PH3<AsH3
⑥已知2H2(g)+O2(g)=2H2O(l) △H=﹣571kJ·mol﹣1,则氢气的燃烧热为285.5kJ·mol﹣1
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N
A.②④⑥ B.①③⑤⑦ C.②④⑥⑦ D.①⑤⑥⑦
某溶液中可能含有Na+、Fe2+、Br-、CO32-、I-、SO32-六种离子中的几种。①在该溶液中滴加足量氯水后,有气泡产生、溶液呈橙黄色;②向呈橙黄色的溶液中加入BaCl2溶液时无沉淀生成;③向淀粉溶液中滴加橙黄色溶液未变蓝色。根据上述实验事实推断,在该溶液中肯定存在的离子组是()
| A.Na+、Br-、CO32- | B.Na+、 I-、SO32- |
| C.Fe2+、I-、SO32- | D.Fe2+、Br-、CO32- |
根据下列化学实验事实得出的结论一定正确的是()
| A.向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解。结论:该溶液中含有SO42- |
| B.向某无色溶液中加入足量盐酸,产生能使澄清石灰水变浑浊的气体。结论:该溶液中含有CO32—或HCO3— |
| C.向1 mL浓度均为0.05 mol/L的NaCl、NaI混合溶液中滴加2滴0.01 mol /L的AgNO3溶液,振荡,沉淀呈黄色。结论:Ksp(AgCl)<Ksp(AgI) |
| D.向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝。结论:该溶液中有NH4+ |