设nA 为阿伏加德罗常数的数值 ,下列说法正确的是(相对原子质量:O-16)
| A.常温下,8gO2和O3的混合气体中含有4nA个电子 |
| B.1molFe2+与足量的H2O2溶液反应,转移2nA个电子 |
| C.1 L 0.1 mol ·L-1NaHCO3液含有0.1nA个HCO3- |
| D.常温常压下,22.4L的NO2 和CO2混合气体含有2 nA个氧原子 |
碱性电池有容量大,放电电流大的特点,被广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn + 2MnO2 + H2O=Zn(OH)2+Mn2O3。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为2MnO2 + H2O+2e-==Mn2O3 + 2OH- |
| C.外电路中每通过0.2mol电子,锌的质量理论上减少13g |
| D.电池工作时,电子由负极通过外电路流向正极 |
下列说法中,正确的是
| A.已知25℃时NH4CN水溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN) |
| B.25℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL0.01 mol·L-1NH4Cl溶液中的Ksp小 |
| C.pH试纸测得新制氯水的pH为4.5 |
| D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
下述转化关系可用于合成解痉药奥昔布宁的前体(化合物丙)。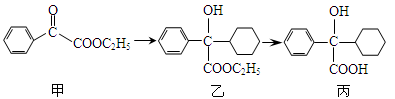
下列说法正确的是
| A.化合物甲的分子式为C10H10O3,分子中的含氧官能团有醛基和酯基 |
| B.化合物乙能发生消去反应,且生成的有机物能和溴发生加成反应 |
| C.化合物乙与NaOH水溶液在加热条件下反应生成化合物丙 |
| D.化合物丙能和氯化铁溶液发生显色反应 |
下列事实,不能用勒夏特列原理解释的是
A.溴水中有平衡:Br2+H2O HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 HBr+ HBrO 加入 AgNO3溶液后,溶液颜色变浅 |
| B.合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
| C.高压比常压有利于合成SO3的反应 |
D.对CO(g) + NO2 (g)  CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深 CO2 (g)+ NO(g) 平衡体系增大压强可使颜色变深 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.标准状况下,18gD2O中所含的质子数为10NA |
| B.标准状况下,11.2LO2参加反应转移的电子数一定为2 NA |
| C.28gN2和CO的混合气体中含有的分子数为NA |
| D.5.6g铁与足量稀硫酸反应失去电子数为0.3 NA |