设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.16g CH4含有10nA个电子 |
| B.常温常压下,22. 4L Cl2含有2nA个Cl原子 |
| C.1 mol Cu与足量稀HNO3反应,转移3nA个电子 |
| D.1L 0.1 mol•L-1Na2SO3溶液中含有0. 1nA个SO32- |
室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2,CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s) 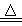 CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是()
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是()
| A.△H2>△H3 | B.△H1<△H3 | C.△H1+△H3=△H2 | D.△H1+△H2>△H3 |
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是()
| A.a为电池的正极 |
| B.电池充电反应为LiMn2O4=Li1-xMn2Ox+xLi |
| C.放电时,a极锂的化合价发生变化 |
| D.放电时,溶液中Li+从b向a迁移 |
向10mL一定物质的量浓度的盐酸中滴加一定物质的量浓度的NaOH溶液,其pH变化如右图所示,则两溶液的物质的量浓度分别是()
| A |
B |
C |
D |
|
| 盐酸的物质的量浓度mol/L |
0.12 |
0.04[来 |
0.03 |
0.09 |
| NaOH的物质的量浓度mol/L |
0.04 |
0.12 |
0.09 |
0.03 |
一定温度下,下列溶液的离子浓度关系式正确的是()
| A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1 |
| B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 |
| C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
| D.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③ |
可逆反应aA(g)+bB(g) cC(g)+dD(g);ΔH同时符合下列两图中各曲线的规律的是()
cC(g)+dD(g);ΔH同时符合下列两图中各曲线的规律的是()
| A.a+b>c+d T1<T2 ΔH<0 | B.a+b>c+d T1<T2 ΔH>0 |
| C.a+b<c+d T1>T2 ΔH<0 | D.a+b>c+d T1>T2 ΔH>0 |