I.工业上可用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)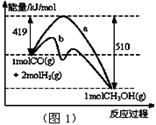
(1)“图1”表示反应中能量的变化,曲线 (填“a或b”)表示使用了催化剂;该反应的热化学方程式为 。
(2)若容器容积不变,下列措施可增大CO平衡转化率的是_____。
| A.升高温度 |
| B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 |
| D.再充入1 mol CO和2 mol H2 |
(3)其他条件不变,请在“图2”中画出温度为T2(且T2<T1)时,CO的平衡转化率与H2和CO的起始组成比[n(H2)/n(CO)]的关系曲线。
II.向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生的反应可表示为:BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。
(4)现有0.20 mol BaSO4,加入1.0L 2.0mol/L的饱和Na2CO3溶液处理,假设起始的c(SO42-)≈0,平衡时,K=4.0×10-2,求达到平衡时发生转化的BaSO4的物质的量。(写出计算过程,计算结果保留2位有效数字)
氧元素的同素异形体有臭氧和氧气 。现采用以下方法测定臭氧的化学式:取O2和Om的混合气体,从其中取出体积相同的两份气体。往1份气体中加松节油,Om完全被吸收,结果气体体积减少了VmL;加热另1份气体,使其中Om全部分解为O2,则气体体积增加V/2 mL(体积都是在同温同压下测定),则m为多少?
(1)将2mol SO2和1mol O2放入2L密闭容器中发生如下反应:
2SO2+O2 2SO3△H<0
2SO3△H<0
当达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,如下图表示:
(1)a b过程中改变的条件可能是 ;
(2)b c过程中改变的条件可能是;
(3)若增大压强时,反应速度变化情况画在c~d处;
(4) 达到第一个平衡时,测得平衡时SO3的浓度为0.5mol/L。请计算此条件下的平衡常数和SO2的转化率。(要求写出解题过程)
将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)="0.3" mol/L。试计算:
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。
(2)溶液稀释后,c(H+)是多少?
已知SO2和H2O2在溶液中发生如下反应:H2O2+SO2===H2SO4。取0.6g某含硫、铁的物质,将它在氧气中灼烧,使硫全部转化为SO2,用稀的过氧化氢溶液吸收。吸收液恰好与20.0mL1mol/LNaOH溶液反应。求:
(1)此物质中硫的质量分数;
(2)此物质中铁与硫的原子个数之比(取整数比)。
9分)将一定质量铁、铝组成的混合物投入到足量的稀硫酸中,充分反应后收集到标准状况下的H25.6L;若将等质量的上述混合物与足量的NaOH溶液反应,在标准状况下产生H23.36L。则混合物中铁的质量分数为多少。