回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图: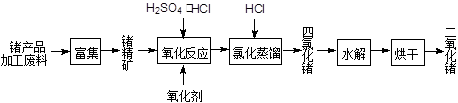
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为 。
温度对GeCl4的水解率产生的影响如图1所示,其原因是 。 为控制最佳的反应温度,实验时可采取的措施为 (填序号)。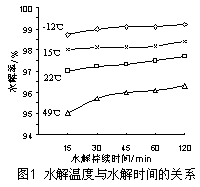
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 。
| pH |
4 |
5 |
6 |
7 |
8 |
9 |
| 溶解率/% |
47.60 |
32.53 |
11.19 |
5.27 |
1.96 |
8.85 |
(1)化合物A含C、H、O三种元素,相对分子质量为60,其中碳和氢的质量分数分别是60%和13.3%。A在催化剂Cu的作用下被氧化成B,B能发生银镜反应,则A的结构简式是________ ________,B发生银镜反应的化学方程式__________________________________________
(共8分)已知乳酸是酸性比碳酸强的弱酸,其结构简式为 。问:
。问:
⑴写出乳酸与足量金属钠反应的化学方程式__________ __。
⑵写出乳酸与少量小苏打水反应的离子方程式。
⑶乳酸在催化剂作用下可发生双分子间缩水反应生成环酯,其反应的化学方程式为: ______ __________。
⑷乳酸还可在催化剂作用下,发生分子间缩水生成聚酯,其反应方程式为: _________
已知化合物
A的分子式为C3H6O2,有如下转化关系:已知B的分子比C的分子少一个碳原子。按要求填写: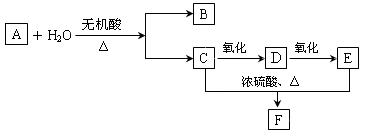
(1)A的结构简式
(2)B的分子式
(3)D的名称
(4)写出下列转化的化学反应方程式:
①A→B+C:。
②C→D:。
.有下列烃的衍生物中:①溴乙烷②苯酚③乙醛④乙酸⑤乙醇⑥乙酸乙酯
(1)与新制的氢氧化铜悬浊液混合加热能生成红色沉淀的是,(填序号,下同)有关的化学方程式为:。
(2)与碳酸钠溶液反应的有;
(3)在一定条件下能发生消去反应的是;
(4)常温下能与浓溴水发生反应生成白色沉淀的是;有关的化学方程式为:。
(5)在一定条件能发生水解反应的是;
(6)写出由④生成⑥反应的化学方程式_____________________________;
反应类型是。
A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(副产物已略去)。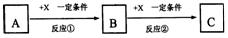
试回答:
(1)若X是强氧化性单质,则A不可能是。
a、S b、N2 c、Na d、Mg e、Al
(2)若X是金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,
则B的化学式为;C溶液在贮存时应加入少量X,理由是(用必要的文字和离子方程式表示),检验此C溶液中金属元素价态的操作方法是
_____________________________________________________________________________。
(3)若A、B、C为含金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为,X的化学式可能为(写出不同类物质)或,反应①的离子方程式为或。