碘元素有“智力元素”之称。研究性学习小组做了如下实验探究海带中碘元素存在并测定其中碘元素的含量。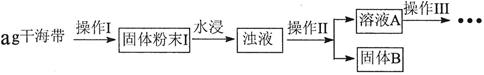
(1)操作I为灼烧,则灼烧时用____盛装海带,操作II为____________________________;
(2)水浸时通常要将悬浊液煮沸2~3min,目的是______________________________;
(3)操作III,是同学们对溶液A中碘元素的存在形式进行的探究实验。
[推测]:①以IO3ˉ形式存在; ②以Iˉ形式存在
[查阅资料]:IO3ˉ具有较强的氧化性,I2+2S2O32ˉ=2Iˉ+S4O62ˉ
将上述溶液稀释配制成200mL溶液,请完成下列实验探究。限选试剂:3%H2O2溶液、KSCN溶液、FeCl2溶液、稀硫酸。
| 序号 |
实验方案 |
实验现象 |
结论 |
| ① |
取少量稀释后的溶液A加入淀粉后再用硫酸酸化,分装于试管I、II |
无现象 |
|
| ② |
往试管I中加入______ |
无现象 |
证明不是以IO3ˉ形式存在 |
| ③ |
往试管II中加入_______ |
_______________ |
证明以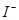 形式存在 形式存在 |
(4)定量检验海带中的碘含量:
①取20mL稀释后溶液A分别于锥形瓶,分别用酸式滴定管滴加0.01mol/LKMnO4溶液至溶液刚显浅红色,将Iˉ氧化为I2并得到溶液B;
②在溶液B加入两滴淀粉溶液,用0.01mol/LNa2S2O3溶液,滴定至终点,终点现象为___________,记录数据,重复上测定步骤①、②两次,三次平均消耗Na2S2O3溶液体积为VmL,计算海带中碘元素的百分含量_________________.(假设操作I、II过程中碘不损失,相对原子量I-127)
(10分)已知芳香族化合物A、B、C、D的化学式均满足C8H8Ox,请按要求回答下列问题:
(1)A、B、C均为x=2的苯环上只有一个侧链的化合物,三者在碱性条件下可以发生如下反应:
A
 E(C7H6O2)+ F
E(C7H6O2)+ F
B
 M(C6H6O)+ J
M(C6H6O)+ J
C
 N(C7H8O)+ P
N(C7H8O)+ P
①写出C在NaOH溶液中反应的反应类型为,化学方程式。
②排列M、N、E三者的酸性强弱(用三者的中文名称表示)
(2)D为x=3的芳香族化合物,请写出一种有两个对位取代基,且能发生银镜反应的有机物的结构简式。
(3)当x=4时其中有一种化合物的结构简式为: 为实现以下物质的转化
为实现以下物质的转化
请用化学式填写下列空白处所需加入的适当试剂①②③。
(8分)现有七瓶无标签的液体,可能是①乙醇、②乙酸、③苯、④乙酸乙酯、⑤油脂、⑥葡萄
糖溶液、⑦蔗糖溶液,现通过以下步骤来确定各试剂瓶中所装液体的名称。
| 实验步骤和方法 |
实验现象 |
| Ⅰ.把7瓶液体分别依次标号A、B、C、D、E、F、G后闻气体 |
只有F、G两种液体没有气味 |
| Ⅱ.各取少量于试管中加水稀释 |
只有C、D、E三种液体不溶解而浮在水上层 |
| Ⅲ.分别取少量7种液体于试管中加新制的Cu(OH)2悬浊液并加热 |
只有B使沉淀溶解,F中产生红色沉淀 |
| Ⅳ.各取C、D、E少量于试管中,加稀NaOH溶液并加热 |
只有C仍有分层现象,且在D的试管中闻到特殊香味 |
给部分试剂瓶重新贴上标签:
A、C、D、G 。
(10分)实验室制取少量溴乙烷的装置如下图所示,根据题意完成下列填空: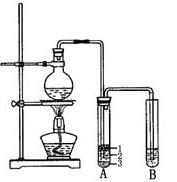
(1)圆底烧瓶中加入的反应物是溴化钠、乙醇 和1:1的硫酸,加热时烧瓶中发生的主要化学反应为NaBr+H2SO4 = HBr+NaHSO4;HBr+CH3CH2OH CH3CH2Br+H2O实验中欲配制体积比1:1的硫酸所用的定量仪器为(选填编号)。
CH3CH2Br+H2O实验中欲配制体积比1:1的硫酸所用的定量仪器为(选填编号)。
a.天平b.量筒c.容量瓶 d.滴定管
(2)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是。
试管A中的物质分为三层(如图所示),产物在第层。
(3)试管A中除了产物和水之外,还可能存在、(写出化学式)。
(4)用浓硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其杂质的正确方法是(填编号)。
a.蒸馏 b.氢氧化钠溶液洗涤
c.用四氯化碳萃取 d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是。
(5)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是:。
(14分)某化学小组设计如图装置完成一组实验:
(1)甲同学设计实验Ⅰ:查阅资料知,硅酸钠(Na2SiO3)溶液与较硅酸(H2SiO3)强的酸反应生成白色沉淀(H2SiO3)。A中装硝酸,B中装石灰石,C中装硅酸钠溶液。
①该实验目的:________________________________________
②预测实验现象:______________________________________
实验结论:____________________________________________
③乙同学分析甲同学设计的实验方案,认为该方案存在不足,请你分析乙同学的理由___________,提出修改建议:______________________________。
(2)丁同学设计方案Ⅲ:A中装硝酸,B中装石灰石,C中装漂白粉溶液,现象是C装置中产生白色沉淀。他得出酸性:HNO3>H2CO3>HClO。由此得出结论:元素非金属性:N>C>Cl。你认为得出的“结论”是否正确?________(填“正确”或“不正确”),理由是__________________________________。
动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
| 实验步骤 |
实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制得的Na2S溶液中满加新制的氯水 |
B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体 |
| ⑤将铝条投入稀盐酸中 |
E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 |
F.生成淡黄色沉锭 |
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究元素性质的递变规律
(2)实验用品:
试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液,AlC13溶液,NaOH溶液,酚酞溶液等。
仪器:①,②,③,试管夹,镊子,小刀,玻璃片,砂纸,火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和②③的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
⑥ |
| 实验现象(填A—F) |
实验步骤②涉及方程式,实验步骤③涉及方程式。
(4)实验结论:。