阿司匹林是一种历史悠久的解热镇痛药,学名为乙酰水杨酸,结构简式为 。某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
。某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
已知:1、乙酰水杨酸是白色晶体,易溶于乙醇、乙醚,在128~135℃易分解。
2、主要试剂和产品的其它物理常数
| 名称 |
相对分子质量 |
熔点或沸点(℃) |
水溶性 |
| 水杨酸 |
132 |
158(熔点) |
微溶 |
| 醋酸酐 |
102 |
139.4(沸点) |
与水反应 |
| 乙酰水杨酸 |
180 |
135(熔点) |
微溶 |
请根据以上信息回答下列问题:
(1)写出水杨酸与醋酸酐制备阿司匹林的化学方程式 。
(2)制备阿司匹林主反应时,仪器必须干燥的原因是 。
(3)合成阿司匹林主反应时,最合适的加热方法是 ,除酒精灯外,该加热装置还需要的玻璃仪器有 。
(4)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤(即减压过滤),结合提纯流程回答加饱和NaHCO3溶液的目的是 。
(5)最终所得产品可能仍含有少量水杨酸,检验含有水杨酸的操作和现象是
。
某学生用已知质量y g的表面皿,准确称取w g NaOH固体。他在托盘天平的右盘上放(w+y)g砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边(如右图所示):
(1)下面他的操作应该是______________________,使_________________。
(2)若称取的w g NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制500mLNaOH溶液过程示意图中有错误的是(填操作序号)
某研究性学习小组设想将少量Cl2通入Fe2+和I-的混合溶液,来探究Fe2+和I-的还原性强弱。
【提出假设】
假设1:;
假设2:;
假设3:Fe2+和I-的还原性一样强。
【验证假设】
⑴利用以下装置进行试验,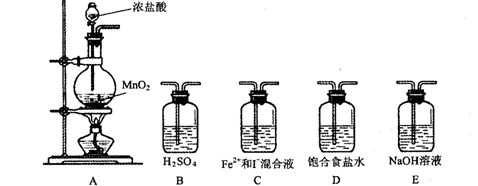
实验必需的装置是:A (按氯气流向的顺序用序号书写)
(按氯气流向的顺序用序号书写) ⑵实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,(能或不能)判断反应的先后顺序。
⑵实验开始后,控制通入少量氯气,通过观察溶液颜色的变化,(能或不能)判断反应的先后顺序。
⑶请在下表中填写实验步骤及预期现象与结论。
| 实验步骤 |
预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加; 向B试管中滴加: |
①若 则假设1成立 ②若 则假设2成立 ③若 则假设3成立 |
⑷该实验成功的关键是控制各反应物的用量。该小组称量1.52gFeSO4(M=152g/mol)和1.66gKI(M=166g/mol)固体溶于水中,为了验证上述假设,通入的氯气的体积最多不能超过。(标准状况)
⑸有同学质疑,上述实验只能验证氯气分别与Fe2+和I-反应的速率的大小。并不能证明Fe2+和I-的还原性强弱。于是提出另一验证方案:往KI溶液中滴加溶液,如果能发生反应,就可证明二者的还原性强弱,该反应的离子方程式是。
回答酸碱滴定实验中的下列问题:
(1)下列有关滴定操作的顺序正确的是_______
①检查滴定管是否漏水②用蒸馏水洗涤玻璃仪器③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管④滴定操作⑤装标准溶液和待测液并调整液面(记录初始读数)⑥取一定体积的待测液于锥形瓶中,并滴加指示剂
A.①③②④⑤⑥ B.①②③⑤⑥④ C.②③①④⑤⑥ D.④⑤①②③⑥
(2)下图Ⅰ表示10 mL量筒中液面的位置,A与B、B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积是__________mL。
(3)下图Ⅱ表示25.00 mL滴定管中 液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_
液面的位置,如果液面处的读数是a,则滴定管中液体的体积(填代号)_ _________。
_________。
A.a mL B.(25—a) mL C.大于a mL D.大于(25—a)mL
(4)上图Ⅲ为用一标准浓度NaOH溶液滴定20.00 mL未知浓度的盐酸时的滴定曲线。则两种溶液的物质的量浓度分别是:c(HCl)=________,c(NaOH)=_______________。
(5)滴定过程中,下列操作中会使测定结果偏低的有____________
A.酸式滴定管未润洗 B.锥形瓶内有少量水
C.滴定前,滴定管尖嘴部分有气泡, 滴定后气泡消失
滴定后气泡消失
D.滴定前仰视滴定管读数,滴定后平视刻度读数
实验室用下列方法测定某水样中O2的含量。
(1)用如右图所示装置,使水中溶解的O2,在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为。
实验步骤:
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是。
②用注射器抽取20.00 mL 某水样从A 处注入锥形瓶。
③再分别从A 处注入含m mol NaOH的溶液及过量的MnSO4 溶液。
④关闭止水夹a、b,将锥形瓶中溶液充分振荡;
(2)用I-将生成的MnO(OH)2再还原为Mn2+,反应的离子方程式为:
MnO(OH)2+2I-+4H+==Mn2++I2+3H2O。
实验步骤:
⑤打开止水夹a、b,分别从A 处注入足量NaI溶液及含n mol H2SO4硫酸溶液。
⑥重复④的操作。
(3)用Na2S2O3标准溶液滴定步骤(2)中生成的I2,反应方程式为:I2+2Na2S2O3==2NaI+Na2S4O6。
实验步骤:
⑦取下锥形瓶,向其中加入2~3滴作指示剂。
⑧用0.005 mol · L-1Na2S2O3滴定至终点。
(4)计算。滴定过程中,滴定前后滴定管中的液面读数如右图所示。
⑨经计算,此水样中氧(O2)的含量为(单位:mg·L-1)。
⑩本实验中所加NaOH溶液和H2SO4溶液中m和n应有一定量的关系,即应加适量的H2SO4使溶液呈(填“酸性”、“碱性”或“接近中性”),其原因是。
用98%的浓H2SO4(ρ=1.84g/cm3)配制240mL0.5mol/L的稀H2SO4,请按要求填空:
(1)所用浓H2SO4的物质的量浓度为 ,配制时所需浓硫酸的体积为mL。(均保留一位小数)
(2)实验中需要用到的定量仪器有。
(3)若实验中出现下列现象对所配溶液的浓度有什么影响?(填“偏高”、“偏低”或“无影响”)
①浓硫酸溶解后未冷至室温即进行转移、定容。()
②定容时俯视刻度线。()
(4)若定容时液面高于刻度线应采取的措施是。
(5)若实验操作全部无误,最后所得的溶液应存放在试剂瓶中,并贴上标签,请你帮助把标签上的内容写一下(如右图)。