在一密闭容器中发生反应: 2A(g)+B(g) E(g)
E(g)
(1)写出该反应的平衡常数表达式___________ ____,已知升高温度时,v(正)>v(逆),此时K值__ __(填“变大”“变小”或“不变”);该反应的△H_____0(填“>”、“=”、“<”);
(2)将1.0mol A和1.0mol B混合后装入2L容器中发生反应,E的物质的量的变化如图所示。
①3分钟内E的平均反应速率为________ _________;
②求此温度下该反应的平衡常数K= (结果保留小数后1位);
③请在图中画出5分钟内A的物质的量变化的曲线;
(3)已知在如图所示的变化中,平衡常数K保持不变,则在5~7min内引起E的物质的量变化的原因可能是____________(填编号)。
①降低了温度 ②升高了温度 ③使用了催化剂 ④增大了容器的体积 ⑤缩小了容器的体积 ⑥减少了A的物质的量。
甲醛是一种重要的化工产品,可利用甲醇脱氢制备,反应式如下:
CH3OH(g) 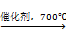 CH2O(g) + H2(g)
CH2O(g) + H2(g)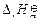 =" 84.2" kJ·mol-1⑴
=" 84.2" kJ·mol-1⑴
向体系中通入空气,通过以下反应提供反应(1) 所需热量:
H2(g) + 1/2O2(g)=H2O(g)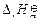 =" –241.8" kJ·mol-1(2)
=" –241.8" kJ·mol-1(2)
要使反应温度维持在700℃,计算进料中甲醇与空气的摩尔数之比。已知空气中氧气的体积分数为0.20。
(1)a值可否等于3(填“可”或“否”)_______,其理由是__________________。
(2)a值可否等于5(填“可”或“否”)_______,其理由是__________________。
(3)a的取值范围是_____________。
(1)3.40 g醇中C、H、O物质的量分别为:C___________mol、H___________mol、O___________mol;该醇中C、H、O的原子数之比为_____________。
(2)由以上比值能否确定该醇的分子式?_____________。其原因是。
(3)如果将该多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有一种,试写出该饱和多元醇的结构简式。_____________。
已知某厂每天排出10000m3尾气(已折算为标准状况),内含0.268%(体积分数)的SO2,SO2可完全转化为H2SO4,若用黄铁矿来生产同样多的H2SO4,则需要多少克含FeS2
78.2%的黄铁矿?