乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ. 探究银镜反应的最佳实验条件部分实验数据如下表:
| 实验变量 实验序号 |
银氨溶液 /mL |
乙醛的量 /滴 |
水液温度/℃ |
反应混合液的PH |
出现银镜时间/min |
| 1 |
1 |
3 |
65 |
11 |
5 |
| 2 |
1 |
3 |
45 |
11 |
6.5 |
| 3 |
1 |
5 |
65 |
11 |
4 |
| 4 |
1 |
3 |
30 |
11 |
9 |
| 5 |
1 |
3 |
50 |
11 |
6 |
| 6 |
1 |
5 |
80 |
11 |
3 |
请回答下列问题:
(1)读表若只进行实验1和实验3,其探究目的是 。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间是 ;要探索不同水浴温度下乙醛进行银镜反应的最佳条件,除了测量银镜出现的时间外,还需要比较不同条件下形成的银镜的 。
(3)进一步实验 若还要探索银氨溶液的用量对出现银镜快慢的影响,如何进行实验?
。
Ⅱ. 探究对废液的回收处理:
银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程为: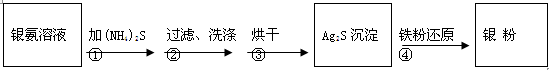
操作④的方法是:把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉。反应的化学方程式为:Ag2S+Fe+2HCl 2 Ag+ FeCl2+H2S↑。
2 Ag+ FeCl2+H2S↑。
(4)若获得的银粉中含有少量没有反应完的铁粉,除去铁的反应的离子方程式为: ,需要用到的玻璃仪器有 (填编号)。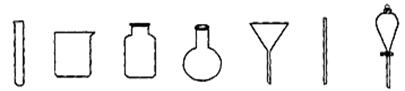
a b c d e f g
(5)操作④应在(填实验室设备名称) 中进行。
(6)要洗去试管壁上的银镜,采用的试剂是 (填名称)。
(16分)某天然碱的化学组成可能为aNa2CO3·bNaHCO3·cH2O(a、b、c为正整数),为确定其组成,化学兴趣小组的同学进行了如下实验:
(1)定性分析
①取少量天然碱样品放入试管中,用酒精灯加热,在试管口有液体生成,该液体能使无水硫酸铜变蓝。能否说明样品中含结晶水,试简述理由。
②请你设计一个简单的实验方案,确认样品中含有CO32—离子。
(2)定量分析
该小组同学设计了下图所示装置,测定天然碱的化学组成。
A B C D E
实验步骤:
①按上图(夹持仪器未画出)组装好实验装置后,首先进行的操作是。
A处碱石灰的作用是。
②称取天然碱样品7.3g,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶的质量为 87.6g,装碱石灰的U型管D的质量为74.7g。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热,待不再产生气体为止。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后称得装浓硫酸的洗气瓶质量为88.5g;装碱石灰的U型管D的质量为75.8g。该步骤中缓缓鼓入空气数分钟的目的是
。
计算推导:
该天然碱的化学式为。
(6分)(1)指出下列实验用品或仪器(已经洗涤干净)使用时的第一步操作:
①石蕊试纸(检验气体性质);
②容量瓶。
(2)下列有关化学实验操作中“先”与“后”的说法正确的是(填代号)。
| A.用排水法收集气体后,先移出导管,后撤酒精灯 |
| B.给试管加热时,先均匀加热,后局部加热 |
| C.碱液流到桌子上,先用稀醋酸溶液中和,后用水洗 |
| D.浓硫酸不慎洒到皮肤上,先迅速用水冲洗,后涂上3%-5%的NaHCO3溶液 |
E.点燃可燃性气体(如H2、CO、C2H4等)时,都要先检验气体纯度,后点燃
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属状态 |
c(H2SO4) /mol·L-1 |
V(H2SO4) /mL |
溶液温度/℃ |
金属消失的时间/s |
|
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
30 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,对反应速率有影响,,反应速率越快,能表明同一规律的实验还有(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);
(3)本实验中影响反应速率的其他因素还有,其实验序号是;
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
。
(一)某同学在一只烧杯里装入一定量的纯铁粉,加入200mL 6mol/L的硝酸,铁粉恰好溶解,请探究产物中铁元素价态:
(1)提出假设:
假设1:产物只有+2价铁;
假设2:___________________________________;
假设3:___________________________________。
(2)设计实验:取反应所得溶液分别装入甲、乙两支试管,在甲中滴加酸性KMnO4溶液;在乙中滴加KSCN溶液,观察现象,推测实验现象与结论:
①若现象为____________________,则假设1正确;
②若现象为____________________,则假设2正确;
③若现象为____________________,则假设3正确。
(二)、氯化铁是常见的水处理剂,工业上制备无水FeCl3的流程为:
(3)吸收剂X为FeCl2溶液,其与尾气Cl2反应的离子方程式__________________。
(4)称取上述样品m克溶于25mL稀盐酸,用蒸馏水配成50mL溶液,加入稍过量的KI溶液充分反应: ,用淀粉作指示剂,用
,用淀粉作指示剂,用 溶液进行滴定
溶液进行滴定 ,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56 Cl:35.5)
,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56 Cl:35.5)
(5)用FeCl3溶液(32%-35%)腐蚀铜板电路时所得废液含FeCl3、FeCl2和CuCl2,若用化学方法回收废液中的铜,简述操作要点:___________________________________________________。
过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下: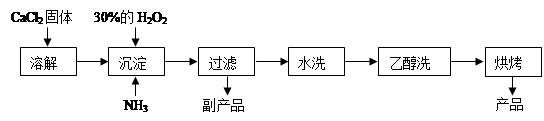
已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是;
(2)检验“水洗”是否合格的方法是;
(3)沉淀时常用冰水控制温度在0℃左右,其可能原因是(写出两种):
①;②。
(4)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L—1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
[已知:I2+2S2O32-= 2I-+S4O62-]
①CaO2的质量分数为(用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能(填“不受影响”、“偏低”或“偏高”),原因是_______________。