NiSO4•6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等元素的化合物杂质)为原料获得。有关工艺流程如下:
(1)往废渣中加H2SO4酸漫,要充分搅拌,其目的是 。
(2)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式 。
(3)加6%的H2O2时,温度不能过高,其目的是 。
(4)除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,用NaClO3氧化Fe2+的离子方程式为 。
(5)上述流程中滤液III的溶质的主要成分是: 。
(6)操作I包括以下过程:过滤,用H2SO4溶解, 、 、过滤、洗涤获得产品。
(12分)化学是一门以实验为基础的学科,试回答以下问题。
(1)选用装置甲、戊制取并收集少量氨气,氨气应从收集装置的 (填“长”或“短”)导管进气,写出利用该装置制备氨气的化学方程式 。
(2)选用装置乙、丙制备少量一氧化氮气体,乙中塑料板上若放置大理石,则装置乙的作用是 ,丙中产生NO的离子方程式为 。
(3)二氧化氯(ClO2)为A1级消毒剂,某研究小组利用丁装置制备ClO2。
①在烧瓶中放入KClO3和草酸(H2C2O4),然后加入足量的稀硫酸,水浴加热。反应生成ClO2、CO2和一种酸式盐,则该反应中氧化产物与还原产物物质的量之比为 。
②温度过高时,二氧化氯的水溶液有可能引起爆炸。在反应开始前将烧杯中的水加热到80℃,然后停止加热,并使其保持在60~80℃之间,丁装置中缺少的一种必需的玻璃仪器名称是 。
③将二氧化氯溶液加入到硫化氢溶液中,加入少量的稀盐酸酸化过的氯化钡溶液,发现有白色沉淀生成,该沉淀的化学式为 。
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________ __________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示) 。正确的检验方法是:取少量待测液,加入 (写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
(5)将粗K2FeO4产品经重结晶、过滤、 、 ,即得较纯净的K2FeO4。
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
| a.用干燥洁净的烧杯取约10 mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速伸入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
①碳与浓硝酸的反应,说明浓硝酸具有 性。
②反应产生的热量会使少量浓硝酸受热分解,写出反应的化学方程式 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。小组同学为了研究助燃气体是O2还是NO2,设计了以下实验。
Ⅰ.制取NO2气体。
①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
②NaOH溶液的作用是吸收多余的NO2,反应生成两种物质的量相等的正盐,写出这两种盐的化学式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式 。
②试分析:是否需要增加带火焰的木炭与纯净O2反应的实验 。
③通过实验探究,你认为助燃气体是什么,简述理由 。
某研究小组想探究炭与浓硝酸的反应。其实验过程如下。
| 操作 |
现象 |
| a.用干燥洁净的烧杯取约10mL浓硝酸,加热。 |
|
| b.把小块烧红的木炭迅速放入热的浓硝酸中。 |
红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮,上下反复跳动。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
①炭与浓硝酸的反应,说明浓硝酸具有 性。
②反应产生的热量会使少量浓硝酸受热分解,该反应的化学方程式为 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。小组同学为了研究助燃气体是O2还是NO2,设计了以下实验。
Ⅰ.制取NO2气体。
①在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
②NaOH溶液的作用是吸收多余的NO2,反应生成两种物质的量相等的正盐,写出反应的的离子方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
①根据实验现象写出碳与NO2气体反应的化学方程式 。
②通过实验探究,你认为上表操作b中助燃气体是什么,简述理由 。
(15分)硫代硫酸钠俗称“海波”,又名“大苏打”,具有较强的还原性和配位能力,是冲洗照相底片的定影剂,棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图(a)所示。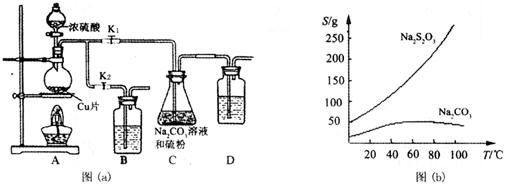
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示。
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。写出烧瓶内发生反应的化学方程式 。装置B、D的作用是 。
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH 时,打开K2、关闭K1并停止加热;C中溶液要控制pH的理由是 。
步骤4:过滤C中的混合液,将滤液经过 、 、过滤、洗涤、烘干,得到产品。
(2)Na2 S2O3性质的检验:
向足量的新制氯水中滴加Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42—全部转化为Cr2O72—;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L—1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00 mL。部分反应的离子方程式为:
①Cr2O72— + 6I—+ 14H+ ="=" 2Cr3+ + 3I2 + 7H2O;
②I2 + 2S2O32— ="=" 2I—+ S4O62—
则该废水中Ba2+的物质的量浓度为 。