若阿伏加德罗常数的数值为NA,则下列说法中正确的是
| A.1.0L0.1 mol·L-1Na2S溶液中含有的S2-离子数小于0.1NA |
| B.1 molFe与过量的氯气反应,转移电子的数目为2 NA |
| C.2.24LCO和CO2混合气体中含有的碳原子数目为0.1NA |
| D.50mL18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
在一定条件下,向体积为2L的密闭容器中加入2 mol N2和10 mol H2发生如下反应:
N2+3H2 2NH3,2min时测得剩余的N2为1mol,则化学反应速率的表示不正确的是()
2NH3,2min时测得剩余的N2为1mol,则化学反应速率的表示不正确的是()
| A.v(N2)=0.25mol·L-1·min-1 | B.v(H2)="0.0125" mol·L-1·s-1 |
| C.v(NH3)="1.0" mol·L-1·min-1 | D.v(H2)="0.75" mol·L-1·min-1 |
恒温恒压下,对于反应X2(g)+ Y2(g) 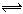 2XY(g)达到平衡状态的标志是 ()
2XY(g)达到平衡状态的标志是 ()
| A.V正(X2)=2V逆(XY) |
| B.单位时间内生成2n mol XY的同时,生n mol的Y2 |
| C.容器内气体密度不随时间而变化 |
| D.X2、Y、XY的浓度之比为2:2:1 |
升高温度能使反应速率加快,下列叙述正确的是()
| A.降低反应所需的活化能 |
| B.使反应体系的活化分子百分数增大 |
| C.体系中活化分子总数不变 |
| D.对于吸热反应、放热反应,反应速率同等程度加大 |
在水溶液中存在反应:Ag++Fe2+ Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是()
Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是()
| A.升高温度 | B.加水稀释 |
| C.增大Fe2+的浓度 | D.常温下加压 |
100mL 4mol/L 稀硫酸与2g锌粒反应,在一定温度下为了减缓反应的速率,但又不影响生成氢气的总量,可向反应物中加入()
| A.硫酸钠固体 | B.硫酸铜固体 | C.硝酸钾溶液 | D.氯化钠溶液 |